题目内容
9.把3.9gNa2O2放入100mL水中,充分反应后,计算:(1)生成O2的体积(标准状况);
(2)反应后所得NaOH的物质的量浓度(反应前后溶液体积变化忽略不计).
分析 (1)n(Na2O2)=$\frac{3.9g}{78g/mol}$=0.05mol,过氧化钠和水反应生成氢氧化钠和氧气,根据过氧化钠和氧气之间的关系式计算氧气体积;
(2)根据钠原子守恒计算NaOH的物质的量,再根据c=$\frac{n}{V}$计算溶液浓度.
解答 解:(1)过氧化钠的物质的量为:n(Na2O2)=$\frac{3.9g}{78g/mol}$=0.05mol,
过氧化钠和水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,据此可得关系式2Na2O2----O2,
所以生成的氧气在标准状况下的体积为:$\frac{0.05mol}{2}$×22.4L/mol=0.56L,
答:生成标准状况下氧气的体积为0.56L;
(2)根据钠原子守恒得n(NaOH)=2n(Na2O2)=2×0.05mol=0.1mol,c(NaOH)=$\frac{0.1mol}{0.1L}$=1mol/L,
答:所得溶液中溶质的物质的量浓度为1mol/L.
点评 本题考查了物质的量的有关计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
相关题目
2.下列叙述正确的是( )
| A. | 对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 | |
| B. | CO燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=+285.8kJ/mol | |
| C. | 反应2Mg+CO2=2MgO+C△H<0从熵变角度看,不可自发进行 | |
| D. | 在密闭容器中,2HI(g)?H2(g)+I2(g)△H=+14.9kJ/mol,若投入NA个HI分子,反应平衡时,吸热7.45kJ |
17.检验HCl气体中是否混有Cl2可用( )
| A. | 干燥的蓝色石蕊试纸 | B. | 硝酸银溶液 | ||
| C. | 干燥的有色布条 | D. | 湿润的碘化钾淀粉试纸 |
4.下列各组离子,能在水溶液中大量共存的是( )
| A. | Na+、Ba2+、SO42-、Cl- | B. | Mg2+、K+、Cl-、NO3- | ||
| C. | H+、K+、CO32-、NO3- | D. | Ag+、Ca2+、Cl-、HCO3- |
1.利用如图装置制取溴苯,下列说法不正确的是( )


| A. | 该装置中CCl4的作用是除去产物HBr中混有的Br2蒸气 | |
| B. | 若将液溴改为浓溴水,该反应也能进行 | |
| C. | 通过AgNO3溶液中有淡黄色沉淀产生,说明由苯制溴苯的反应是取代反应 | |
| D. | 该装置中左侧长导管的作用是导气兼冷凝回流 |
18.课外实验小组为了探究锌与盐酸反应过程中的化学反应速率的变化,在100mL稀盐酸中加入足量的锌粉,标准状况下用排水集气法收集反应放出的氢气,实验记录如下(累计值):
(1)哪一时间段2~3 min(指0~1、1~2、2~3、3~4、4~5min,下同)反应速率最大,可能的原因是该反应是放热反应,此时温度高.
(2)哪一段时段的反应速率最小4~5min,原因是H+浓度小.
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为0.1mol/(L•min).
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.蒸馏水B.CH3COONa固体 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是AB(填编号).
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(2)哪一段时段的反应速率最小4~5min,原因是H+浓度小.
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率为0.1mol/(L•min).
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.蒸馏水B.CH3COONa固体 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是AB(填编号).
19.微量元素对人体正常代谢和健康起着重要作用.下列元素不是微量元素的是( )
| A. | I | B. | H | C. | Zn | D. | Fe |
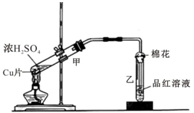 如图为浓硫酸与铜片反应的装置.请回答:
如图为浓硫酸与铜片反应的装置.请回答: 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.