题目内容
8.已知J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.请回答下列问题:| J | ||||
| R |
 ;
;(2)元素T在周期表中的位置是第三周期ⅦA.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2═N2↑+8H2O或2NH3+3H2O2═N2↑+6H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
分析 J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,应为Al元素,而T是原子序数最大的元素,且为短周期主族元素,应为Cl元素,根据元素周期律的递变规律及元素的单质、化合物的性质来解答该题.
解答 解:J元素最低负化合价的绝对值与其原子最外层电子数相等,说明J的最低化合价与最高化合价绝对值相等,则J最外层电子数为4,根据J、R都为短周期元素可知J为C元素,则R应为S元素,M是地壳中含量最多的金属元素,应为Al元素,而T是原子序数最大的元素,且为短周期主族元素,应为Cl元素,
(1)M为Al,质子数为13,其离子结构示意图为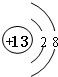 ,
,
故答案为: ;
;
(2)T为Cl,位于第三周期ⅦA,
故答案为:第三周期ⅦA;
(3)①L为N元素,其氢化物为氨气,与过氧化氢反应生成氮气和水,反应为2NH3•H2O+3H2O2═N2↑+8H2O或2NH3+3H2O2═N2↑+6H2O,
故答案为:2NH3•H2O+3H2O2═N2↑+8H2O或2NH3+3H2O2═N2↑+6H2O;
②2NH3+3H2O2═N2↑+6H2O,△H>0,
a.该反应是吸热反应,温度升高,平衡向正反应移动,氨的物质的量减小,故a符合;
b.化学平衡常数只受温度影响,温度升高,平衡向正反应移动,平衡常数增大,故b不符合;
c.加入氢气的物质的量,氢气的浓度增大,氨气的浓度增大,平衡向逆反应进行,氨气的转化率降低,故c符合;
d.加入氨的物质的量,平衡向正反应进行,总的物质的量增大,故d不符合;
故答案为:ac;
(4)JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,298K时放出热量215kJ,则1mol二硫化碳完全燃烧生成稳定氧化物放出的热量为1075kJ,则热化学反应方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol,
故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
点评 本题考查位置、结构、性质的关系及应用,元素的推断是解答本题的关键,涉及原子结构、氧化还原反应、热化学反应方程式,侧重性质和反应原理的考查,注重高考考点的训练,题目难度中等.

①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸
④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体.
| A. | 只有①②④⑤ | B. | 全部 | C. | 只有①② | D. | 只有①②③④ |
| A. | 3.4g NH3中含有的电子数为0.2NA | |
| B. | 标准状况下,22.4L Cl2参加所有化学反应转移的电子数一定都是2NA | |
| C. | 标准状况下,0.5NA个HF分子所占的体积约为11.2L | |
| D. | 500mL 1mol/L氯化铁溶液中的Fe3+数小于0.5NA |
| A. | 构成单质分子的粒子一定含共价键 | |
| B. | 非金属元素组成的化合物一定不是离子化合物 | |
| C. | 第ⅠA族和第ⅦA族原子化合时一定形成离子键 | |
| D. | 共价化合物中一定不含离子键 |
| A. | 容量瓶在使用前应检奄是否漏水 | |
| B. | 实验室需要950mL 0.1mol•L-1NaC1溶液,配制时应选用1000mL容量瓶 | |
| C. | 若移液前容量瓶内有少量水,会使所配溶液浓度偏低 | |
| D. | 配制一定物质的量浓度的溶液时,两次用到玻璃棒,其作用分别是搅拌和引流 |
| A. | 水起着溶解NH4NO3,发生吸热现象以启动反应的作用 | |
| B. | 每还原1molNO3需氧化1molZn和1molNH4+ | |
| C. | 成烟物质是两性氧化物小颗粒 | |
| D. | 发烟物质是小锌粒,它由NH4NO3反应放热而蒸出 |
| A. | 盐酸跟氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 硝酸跟碳酸钠溶液反应:2H++CO32-═CO2↑+H2O | |
| C. | 氯化钠溶液跟硝酸银溶液反应:Ag++Cl-═AgCl↓ | |
| D. | 盐酸跟氢氧化铜反应:H++OH-═H2O |
 图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系:
图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系: 如图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层.把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿.把5g干燥的氧化铁粉末和2g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条.观察发生的现象.通过以上实验信息,回答下列问题:
如图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层.把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿.把5g干燥的氧化铁粉末和2g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条.观察发生的现象.通过以上实验信息,回答下列问题: