题目内容
18.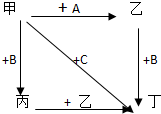 图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系:
图中,乙是一种非金属单质,通常为黄绿色气体,A为一种黑色粉状固体,B是一种常见的金属单质,C是一种红褐色物质,它们之间存在如图关系:请回答:(1)写出甲、乙、丙、丁的名称
甲盐酸乙氯气丙氯化亚铁丁氯化铁
(2)写出实验室制取乙的化学方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(3)写出由丙到丁的离子方程式2Fe2++Cl2=2Fe3++2Cl-
(4)若将乙气体通入水中,所得溶液中主要有Cl2、H2O、HClO、H+、Cl-、ClO-等六种粒子(写微粒符号)
分析 乙是一种非金属单质,通常为黄绿色气体,应为Cl2,一般由二氧化锰和浓盐酸反应制备,则甲为浓盐酸,A为一种黑色粉状固体,应为MnO2,B是一种常见的金属单质,由转化关系可知存在变价,应为Fe,C是一种红褐色物质,应为Fe(OH)3,则丙为FeCl2,丁为FeCl3,以此解答该题.
解答 解:乙是一种非金属单质,通常为黄绿色气体,应为Cl2,一般由二氧化锰和浓盐酸反应制备,则甲为浓盐酸,A为一种黑色粉状固体,应为MnO2,B是一种常见的金属单质,由转化关系可知存在变价,应为Fe,C是一种红褐色物质,应为Fe(OH)3,则丙为FeCl2,丁为FeCl3,
(1)由以上分析可知甲为盐酸,乙为氯气,丙为氯化亚铁,丁为氯化铁,故答案为:盐酸;氯气;氯化亚铁;氯化铁;
(2)实验室由二氧化锰和浓盐酸反应制备氯气,反应的化学方程式为MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(3)由丙到丁的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)氯气和水反应生成盐酸和次氯酸,次氯酸为弱酸,氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-,故答案为:Cl2、H2O、HClO、H+、Cl-、ClO-.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
9.下列各组物质中,都是极性分子的一组是( )
| A. | NH3 H2O | B. | CO2 HCl | C. | NO H2 | D. | CH4 Br2 |
6.下列变化需要加入氧化剂才能实现的是( )
| A. | Fe3+→Fe2+ | B. | S2-→HS- | C. | MnO4-→Mn2+ | D. | SO2→SO3 |
13.将1.4g氮气,1.6g氧气,4g氩气混合,则该混合气体在标准状况下的体积是( )
| A. | 3.36 L | B. | 4.48 L | C. | 6.72 L | D. | 8.96 L |
8.已知J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.请回答下列问题:
(1)M的离子结构示意图为 ;
;
(2)元素T在周期表中的位置是第三周期ⅦA.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2═N2↑+8H2O或2NH3+3H2O2═N2↑+6H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
(4)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
| J | ||||
| R |
 ;
;(2)元素T在周期表中的位置是第三周期ⅦA.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2═N2↑+8H2O或2NH3+3H2O2═N2↑+6H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
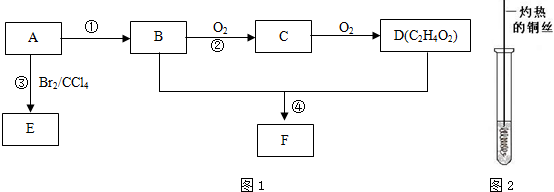
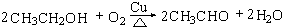 .
. (4)D与碳酸氢钠溶液反应的离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑.
(4)D与碳酸氢钠溶液反应的离子方程式为CH3COOH+HCO3-→CH3COO-+H2O+CO2↑. .
.