题目内容
20.下列有关溶液配制的叙述中错误的是( )| A. | 容量瓶在使用前应检奄是否漏水 | |
| B. | 实验室需要950mL 0.1mol•L-1NaC1溶液,配制时应选用1000mL容量瓶 | |
| C. | 若移液前容量瓶内有少量水,会使所配溶液浓度偏低 | |
| D. | 配制一定物质的量浓度的溶液时,两次用到玻璃棒,其作用分别是搅拌和引流 |
分析 A.容量瓶在使用前要检查是否漏水;
B.实验室没有950mL的容量瓶,需选用1000mL的容量瓶;
C.整个溶液的体积是通过容量瓶来控制的,在定容时就要加蒸馏水,所以容量瓶不需要干燥;
D.在配制一定物质量浓度的氯化钠溶液时,玻璃棒在溶解氯化钠固体时的作用是搅拌,在移液时的作用是引流.
解答 解:A.容量瓶在使用前要检查是否漏水,防止在摇匀时渗漏,故A正确;
B.实验室没有950mL的容量瓶,需选用1000mL的容量瓶来配制,使用时取用950mL即可,故B正确;
C.整个溶液的体积是通过容量瓶来控制的,在定容时就要加蒸馏水,所以移液前容量瓶内有少量水,对所配溶液浓度无影响,故C错误;
D.在配制一定物质量浓度的氯化钠溶液时,玻璃棒在溶解氯化钠固体时的作用是搅拌,在移液时的作用是引流,故D正确;
故选C.
点评 本题考查了一定物质的量浓度溶液的配制过程中的注意示项,属于基础型题目,易错点是容量瓶规格的选择,难度不大.

练习册系列答案
相关题目
11.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 电池放电时Cl-由正极向负极迁移 | |
| C. | 正极反应式为Ag++e-=Ag | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ |
8.已知J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.请回答下列问题:
(1)M的离子结构示意图为 ;
;
(2)元素T在周期表中的位置是第三周期ⅦA.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2═N2↑+8H2O或2NH3+3H2O2═N2↑+6H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
(4)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
| J | ||||
| R |
 ;
;(2)元素T在周期表中的位置是第三周期ⅦA.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2═N2↑+8H2O或2NH3+3H2O2═N2↑+6H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
15.下列各组物质之间,一定互为同系物的是( )
| A. | 乙二醇与丙三醇 | B. | C4H8与C6H12 | ||
| C. | HCOOH与C17H35COOH | D. |  与 与 |
5.下列各物质中相对分子质量相等的是( )
| A. | CO2和SO2 | B. | Ca(OH)2和Cu(OH)2 | C. | H2SO4和H3PO4 | D. | ZnSO4和CuSO4 |
12.在一密闭容器中进行反应:2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g),反应从正反应开始,下列说法错误的是( )
| A. | 开始正反应速率最大 | |
| B. | V正(SO2):V正(O2)=2:1时,反应达到平衡状态 | |
| C. | 达到平衡V逆(SO3)最大 | |
| D. | 开始时V逆(SO3)=0 |
20.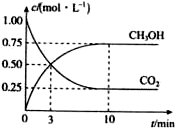 为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)$\frac{\underline{\;高温\;}}{\;}$CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入l mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1.下列叙述中不正确的是( )
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)$\frac{\underline{\;高温\;}}{\;}$CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入l mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1.下列叙述中不正确的是( )
 为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)$\frac{\underline{\;高温\;}}{\;}$CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入l mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1.下列叙述中不正确的是( )
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)$\frac{\underline{\;高温\;}}{\;}$CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入l mol CO2和3mol H2测得CO2和CH3OH(g)的浓度随时间变化的曲线如图所示,且平衡时体系压强为p1.下列叙述中不正确的是( )| A. | 0~3 min内,v(CO2)正=v(CH3OH)正 | |
| B. | 在T1℃时,若起始时向容器中充人2 moI CO2和6 mol H2,测得平衡时容器内压强为p2,则p2<2p1 | |
| C. | 其他条件不变,若向平衡后的体系中充人1 mol氦气,体系压强增大,平衡将向正反应方向移动 | |
| D. | T2℃时,上述反应平衡常数为4.2,则T2>T1 |
 .
.