题目内容
3.设NA为阿伏伽德罗常数的数值,下列叙述正确的是( )| A. | 3.4g NH3中含有的电子数为0.2NA | |
| B. | 标准状况下,22.4L Cl2参加所有化学反应转移的电子数一定都是2NA | |
| C. | 标准状况下,0.5NA个HF分子所占的体积约为11.2L | |
| D. | 500mL 1mol/L氯化铁溶液中的Fe3+数小于0.5NA |
分析 A.3.4g氨气的物质的量为0.2mol,而1mol氨气含有10mol的电子;
B、氯气与氢氧化钠反应,是自身的氧化还原反应,1mol转移1mol电子;
C、气体摩尔体积使用对象为气体;
D、氯化铁是强酸弱碱盐,铁离子会发生水解.
解答 解:A.3.4g氨气的物质的量为0.2mol,而1mol氨气含有10mol的电子,所以3.4g NH3中含有的电子数为2NA,故A错误;
B、氯气与氢氧化钠反应,是自身的氧化还原反应,1mol转移1mol电子,所以不一定都是2NA,故B错误;
C、标况下,HF为液体,不能使用气体摩尔体积,故C错误;
D、氯化铁是强酸弱碱盐,铁离子会发生水解,所以500mL 1mol/L氯化铁溶液中的Fe3+数小于0.5NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是电子总数、物质的量计算微粒数,熟悉相关公式是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.将1.4g氮气,1.6g氧气,4g氩气混合,则该混合气体在标准状况下的体积是( )
| A. | 3.36 L | B. | 4.48 L | C. | 6.72 L | D. | 8.96 L |
14.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成总量的是( )
①K2SO4 ②CH3COONa ③CuSO4 ④Na2SO4.
①K2SO4 ②CH3COONa ③CuSO4 ④Na2SO4.
| A. | ①③ | B. | ②④ | C. | ①②④ | D. | ③④ |
11.Mg-AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是( )
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 电池放电时Cl-由正极向负极迁移 | |
| C. | 正极反应式为Ag++e-=Ag | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ |
18.下列工业产品的生产设计中原子利用率没有达到100%的是( )
| A. | 合成甲醇:CO+2H2$→_{加热加压}^{催化剂}$CH3OH | |
| B. | 合成乙醛:2CH2=CH2+O2$→_{加热加压}^{催化剂}$2CH3CHO | |
| C. | 合成有机玻璃单体-甲基丙烯酸甲酯: 第1步: 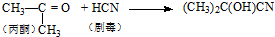 第2步: 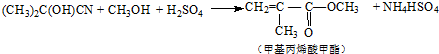 | |
| D. | 合成全降解聚碳酸酯塑料: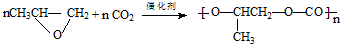 |
8.已知J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.请回答下列问题:
(1)M的离子结构示意图为 ;
;
(2)元素T在周期表中的位置是第三周期ⅦA.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2═N2↑+8H2O或2NH3+3H2O2═N2↑+6H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
(4)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ.该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075KJ/mol.
| J | ||||
| R |
 ;
;(2)元素T在周期表中的位置是第三周期ⅦA.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3•H2O+3H2O2═N2↑+8H2O或2NH3+3H2O2═N2↑+6H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是ac(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 甲的物质的量 | 平衡常数K | 甲的转化率 | 生成物物质的量总和 |
15.下列各组物质之间,一定互为同系物的是( )
| A. | 乙二醇与丙三醇 | B. | C4H8与C6H12 | ||
| C. | HCOOH与C17H35COOH | D. |  与 与 |
12.在一密闭容器中进行反应:2SO2(g)+O2(g)$\frac{\underline{催化剂}}{△}$2SO3(g),反应从正反应开始,下列说法错误的是( )
| A. | 开始正反应速率最大 | |
| B. | V正(SO2):V正(O2)=2:1时,反应达到平衡状态 | |
| C. | 达到平衡V逆(SO3)最大 | |
| D. | 开始时V逆(SO3)=0 |
3.近年来发现铊(Tl)是高温超导材料的成分之一,已知铊与铝是同族元素,关于铊的下列性质判断中,可能错误的是( )
| A. | 是银白色、质软的金属 | B. | 能形成+3价的化合物 | ||
| C. | Tl的金属性强于铝 | D. | 能与硝酸反应放出H2并生成硝酸盐 |