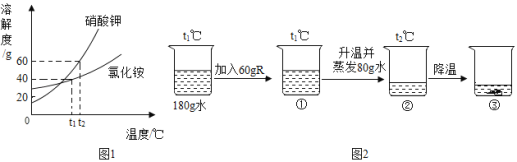
【题目】设计对比试验,控制变量是学习化学的重要方法,下列对比试验不能达到目的是( )
编号 | A | B | C | D |
实验设计 |
|
|
|
|
实验目的 | 区分硬水和软水 | 探究可燃物燃烧的条件 | 探究铁生锈的条件 | 探究 CO2与 NaOH 溶液能否发生反应 |
A.AB.BC.CD.D
【题目】实验室有一瓶标签模糊的氢氧化钠溶液,为了测定其溶质质量分数,小明进行了如下实验:①取一洁净的锥形瓶称量,然后往其中加入一定量的氢氧化钠溶液,并滴入几滴酚酞试液(质量忽略不计),重新称量;②往上述锥形瓶中加入溶质质量分数为7.3%的盐酸,边加边振荡,溶液红色褪去时,再次称量。数据如下表:回答下列问题:
锥形瓶/g | 锥形瓶+氢氧化钠溶液/g | 锥形瓶+反应后溶液/g | |
质量/g | 35.5 | 60.5 | 110.5 |
(1)根据表中数据,通过计算确定该瓶氢氧化钠溶液的溶质质量分数_________。
(2)小建用pH试纸测得小明实验反应后锥形瓶内溶液的pH为4,则小明测出氢氧化钠溶液的质量分数比实际浓度_________(选填“偏大”或“偏小”),造成这一偏差的原因是________。
【题目】根据下列仪器装置,回答有关问题。
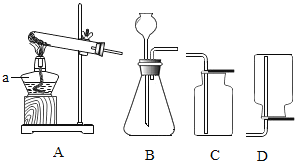
(1)制取氧气。实验室选用装置A制取氧气时,用到的化学药品是__________ (用化学式表示);实验结束熄灭酒精灯的操作为__________。
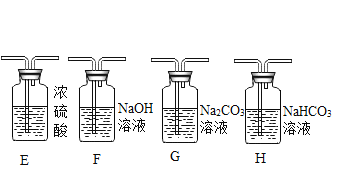
(2)制取二氧化碳。用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为_______________。为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为_____→ H → _____ →干燥、纯净CO2 (在横线内填装置序号)。
(3)进一步探究二氧化碳与氢氧化钠溶液的反应。
(提出问题)制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3 + CO2 + H2O = 2NaHCO3。向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
(查阅资料)碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3 =Na2CO3 + H2O;Ca(HCO3)2溶于水。
(猜想)所得溶液中的溶质是:I.Na2CO3;II.NaHCO3;III.Na2CO3和NaHCO3;IV._____。
(实验)请你参与下列验证猜想③的实验,完成探究报告。
步骤和方法 | 现象 | 分析 |
取少量反应后的溶液,加入足量的CaCl2溶液 | __________ | 发生反应的方程式:_____ |
__________ | 产生白色沉淀 | 结论:猜想III正确 |
(讨论)二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素是________。