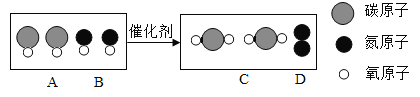
题目内容
【题目】实验室有一瓶标签模糊的氢氧化钠溶液,为了测定其溶质质量分数,小明进行了如下实验:①取一洁净的锥形瓶称量,然后往其中加入一定量的氢氧化钠溶液,并滴入几滴酚酞试液(质量忽略不计),重新称量;②往上述锥形瓶中加入溶质质量分数为7.3%的盐酸,边加边振荡,溶液红色褪去时,再次称量。数据如下表:回答下列问题:
锥形瓶/g | 锥形瓶+氢氧化钠溶液/g | 锥形瓶+反应后溶液/g | |
质量/g | 35.5 | 60.5 | 110.5 |
(1)根据表中数据,通过计算确定该瓶氢氧化钠溶液的溶质质量分数_________。
(2)小建用pH试纸测得小明实验反应后锥形瓶内溶液的pH为4,则小明测出氢氧化钠溶液的质量分数比实际浓度_________(选填“偏大”或“偏小”),造成这一偏差的原因是________。
【答案】(1)16%;(2)偏大;盐酸过量
【解析】
(1)解:设一定量的氢氧化钠溶液所含溶质质量为x
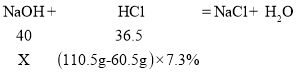
![]()
解得:x=4g
NaOH%= ![]()
答:该瓶氢氧化钠溶液的溶质质量分数为16%。
(2)小建用pH试纸测得,小明实验反应后锥形瓶内溶液的pH为4,说明反应后的溶液呈酸性,生成物氯化钠是中性的,造成酸性的原因是盐酸过量,盐酸量偏大,导致计算出消耗的氢氧化钠也偏大。故填:偏大;盐酸过量。

练习册系列答案
相关题目