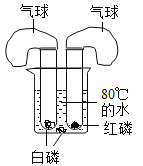
题目内容
【题目】根据下列仪器装置,回答有关问题。
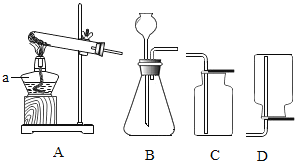
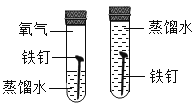
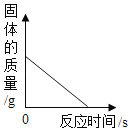
(1)制取氧气。实验室选用装置A制取氧气时,用到的化学药品是__________ (用化学式表示);实验结束熄灭酒精灯的操作为__________。
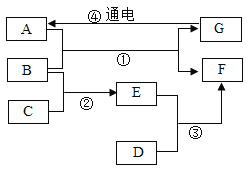
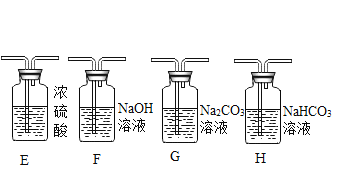
(2)制取二氧化碳。用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为_______________。为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为_____→ H → _____ →干燥、纯净CO2 (在横线内填装置序号)。
(3)进一步探究二氧化碳与氢氧化钠溶液的反应。
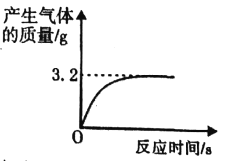
(提出问题)制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3 + CO2 + H2O = 2NaHCO3。向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
(查阅资料)碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3 =Na2CO3 + H2O;Ca(HCO3)2溶于水。
(猜想)所得溶液中的溶质是:I.Na2CO3;II.NaHCO3;III.Na2CO3和NaHCO3;IV._____。
(实验)请你参与下列验证猜想③的实验,完成探究报告。
步骤和方法 | 现象 | 分析 |
取少量反应后的溶液,加入足量的CaCl2溶液 | __________ | 发生反应的方程式:_____ |
__________ | 产生白色沉淀 | 结论:猜想III正确 |
(讨论)二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素是________。
【答案】KClO3、MnO2 用灯帽盖灭 CaCO3 + 2HCl = CaCl2+ H2O + CO2↑ B E NaOH和Na2CO3 产生白色沉淀 CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 过滤,向滤液中加入少量NaOH溶液 通入CO2的量多少
【解析】
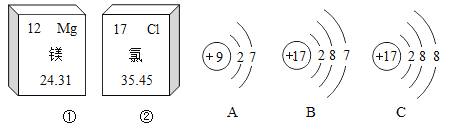
(1)装置A是固体加热型的发生装置,因为试管口没有棉花团,所以不能是高锰酸钾制氧气,只能是氯酸钾和二氧化锰。实验结束熄灭酒精灯的操作为用灯帽盖灭。故填:KClO3和MnO2;用灯帽盖灭。
(2)盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为:
![]() ;制得的二氧化碳气体中可能混有氯化氢气体(来自盐酸)需要饱和碳酸氢钠溶液(B装置)除去,氯化氢能和碳酸氢钠反应生成二氧化碳,出来的二氧化碳还会含有水蒸气,需要浓硫酸(E装置)干燥,所以为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为B→ H → E →C(干燥、纯净CO2)。故填:
;制得的二氧化碳气体中可能混有氯化氢气体(来自盐酸)需要饱和碳酸氢钠溶液(B装置)除去,氯化氢能和碳酸氢钠反应生成二氧化碳,出来的二氧化碳还会含有水蒸气,需要浓硫酸(E装置)干燥,所以为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为B→ H → E →C(干燥、纯净CO2)。故填:![]() ;B;E。
;B;E。
(3)猜想:向氢氧化钠溶液中通入一定量二氧化碳,首先会发生![]() 反应,当二氧化碳的量不足时,溶液中的溶质就会有碳酸钠和未反应的氢氧化钠,故猜想IV为NaOH和Na2CO3;
反应,当二氧化碳的量不足时,溶液中的溶质就会有碳酸钠和未反应的氢氧化钠,故猜想IV为NaOH和Na2CO3;
实验:步骤和方法:要验证猜想III.Na2CO3和NaHCO3正确,取少量反应后的溶液,加入足量的CaCl2溶液,发生反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl ,所以现象是产生白色沉淀碳酸钙,如果有碳酸氢钠,它不与氯化钙反应,因为碳酸氢钙溶于水,不符合复分解反应特点。接着进行过滤,除去碳酸钙沉淀,检验溶液中含有碳酸氢钠,因为氯化钙加入是足量的,所以再向滤液中加入少量氢氧化钠,发生反应:NaOH+NaHCO3 =Na2CO3 + H2O,有碳酸钠产生,遇到过量的氯化钙会产生白色沉淀。从而得出猜想III.Na2CO3和NaHCO3正确。故填:产生白色沉淀;CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl;过滤,再向滤液中加入少量氢氧化钠。
讨论:二氧化碳通入一定量的氢氧化钠溶液,二氧化碳的量不同时,生成物溶液中的溶质也不同。
当二氧化碳量较少时,氢氧化钠没有反应完,溶液中的成分为:氢氧化钠和碳酸钠,对应猜想IV;
当二氧化碳与氢氧化钠恰好完全反应时,溶液成分只有产物碳酸钠,对应猜想I;
当二氧化碳过量时,生成的碳酸钠会继续与二氧化碳反应,Na2CO3 + CO2 + H2O = 2NaHCO3,若过量的二氧化碳不能把全部碳酸钠反应时,溶液中成分为:碳酸钠和碳酸氢钠,对应猜想III;
当二氧化碳的量非常多时,不仅能把氢氧化钠完全反应,还能把生成的碳酸钠也全部反应掉变成碳酸氢钠,此时溶液成分只有碳酸氢钠,对应猜想II。
所以影响反应后生成物成分的决定因素是:二氧化碳的量。故填:二氧化碳的量。

【题目】阅读下面科普短文
碳元素是最早被人类认识和利用的元素。碳元素在地球上虽然广泛分布,但其含量不足0.03%。碳元素是一切有机体骨架的组成元素,在人体中的含量约占 18%。主要以有机含碳化合物形式存在,如糖类、蛋白质等。人体中的无机含碳化合物种类较少,在血浆中主要以碳酸氢盐缓冲系统 (H2CO3/HCO3-)的形式存在。迄今为止,发现了 15 种碳原子,它们在元素周期表中占据如图 1 所示的同一个“格”,其中 C-12 和C-13 属于稳定型,考古研究中,通过测定 C-14 含量估算古物的年代。20 世纪起,人类对碳元素的认识突飞猛进。下表列出了与之相关的主要事件:碳的这些新型结构的发现和性能研究的发展,使其广泛应用于工业、材料、生物医学等领域。依据文章内容回答下列问题:

时间 | 40 年代 | 1967 年 | 1969 年 | 1985 年 | 1991 年 | 21 世纪 |
事件 | 发现C-14 | 发现六角金刚 石和单斜超硬 碳 | 发现银白色的白炭 | 发现富勒烯 的第一个成 员 C60(图 2) | 发现碳纳米管(图 3) | 从石墨中剥离出仅 由一层碳原子构成 的薄片-石墨烯(图4) |
(1)碳在人体中的存在形式有_______ 种;
(2)关于图 1 所示的相关信息分析,错误的是________;
A 原子序数为 6 B 电子数为 12 C 元素符号为 C
(3)结合你所学的知识,你认为原子 C-12 和 C-13 的不同点是________;
A 质子数不同 B 电子数不同 C 中子数不同
(4)从石墨中剥离出来的石墨烯具有优良的各种性能,被认为是一种未来革命性的材料。石墨和金刚石的物理性质不同的原因是________;
(5)富勒烯 C60 中数字“60”的含义是________。