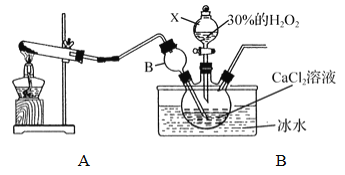
【题目】化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。各小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。

A组:探究催化剂对化学反应速率的影响;
取5mL10%H2O2溶液,三次实验分别加人0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
由此得出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用。
(1)你认为该结论是否正确,为什么?_________________________________________。
(2)经过补充对比实验,证明红砖粉末有催化作用,则三者的催化效率由高到低的顺序为___________。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,,进行实验,记录时间t1。
(3)乙同学:取10mL2.5%H2O2溶液,加入__________为催化剂,进行实验,记录时间t2。
实验结果:_______________________________________________________
结论:___________________________________________________________
【拓展探究】
(4)C组:探究____________对化学反应速率的影响。
各取10mL5%H2O2溶液和0.5gCuO为催化剂进行实验,两次实验分别将试管置于冰水浴和50℃热水浴,记录时间t3、t4。
(5)实验结果:_________________________;
结论:当反应物浓度和催化剂相同时,__________________________________。
(6)以上三组实验说明,影响化学反应速率的因素有:________________________。
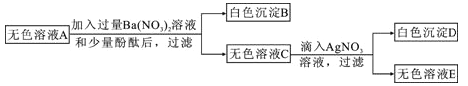
【题目】小明、小芳二位同学为探究盐酸的化学性质,,做了如下实验:

(1)若用pH试纸测该盐酸的pH值,则具体操作为___________。
(2)反应后试管C中一定含有的阳离子是___________(写离子符号);试管D中反应的化学方程式为_________________________________。
(3)小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成,过滤,得到白色沉淀和无色滤液。
小明同学欲探究无色滤液中的溶质成分:
小明同学分析得出无色滤液中一定不含HCl,理由是______________________。
(4)【提出问题】无色滤液的溶质是什么?
【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl和Na2CO3。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加少量①____________ | 无明显现象 | 猜想③成立 |
取少量滤液于试管中,滴加稀盐酸 | ②___________ |