题目内容
【题目】有一包粉末,已知由BaSO4、FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行以下实验,各步骤均已充分反应。
步骤一:取一定质量的粉末,加水搅拌后过滤,得到有色沉淀甲和无色溶液A;
步骤二:向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失并得到黄色溶液;
步骤三:将步骤一得到的无色溶液A进行如下图所示的实验。
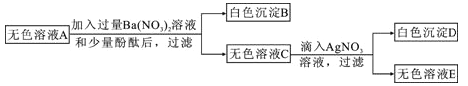
则下列说法中正确的是:
A. 原白色粉末中一定有FeCl3、Na2SO4、NaOH
B. 有色沉淀甲可能是Fe(OH)3和BaSO4 的混合物
C. 若将步骤二中的盐酸换成硝酸,则可确定原白色粉末是否含有NaCl
D. 原白色粉末中FeCl3和NaOH的质量比为65:48
【答案】B
【解析】向①步得到的沉淀中加入足量稀盐酸,得到黄色溶液,说明沉淀中含有氢氧化铁,说明原物质中含有的氯化铁和氢氧化钠,反应产生氯化钠,且无色滤液A不能使酚酞变色,因此滤液A没有氯化铁、氢氧化钠,还有氯化钠;滤液A能够和硝酸钡产生白色沉淀,因此滤液A中还有硫酸钠,同时说明没有硝酸钡;氯化钠能够和硝酸银反应产生氯化银沉淀;故A中一定存在的溶质的化学式是:Na2SO4、NaCl;向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失,因此没有硫酸钡,原有氯化钠是否存在对本题的现象没有明显的影响,所以这包粉末中一定含有物质的化学式是:FeCl3、Na2SO4、NaOH;由于都不知道反应过程中各物质的量,故无法确定物质间的质量比,综上所述,只有B正确。故选B。

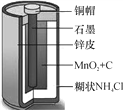
【题目】某同学对碳酸钙高温加热一段时间剩余固体的成分进行探究。
(1)写出高温分解的化学方程式________________。
(2)取反应后的少量固体于试管中,加适量水振荡,静置,有不溶物出现,过滤。
(3)向滤渣中滴加过量稀盐酸,有气泡。固体中一定含有_______。
(4)某兴趣小组用图1装置进行实验时发现:烧杯中饱和石灰水未变浑浊,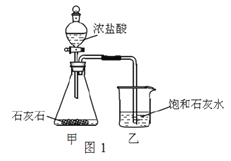
①写出甲装置中发生反应的化学方程式_________________________。
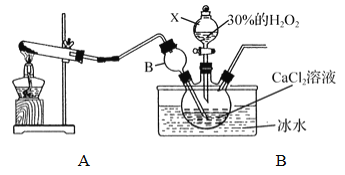
②为探究“饱和石灰水未变浑浊的原因”,开展了如下活动:
分析原因: 可能是澄清石灰水已变质; 也可能是生成的气体中除了有CO2外,还有____________;
实验探究: 将生成的气体X通入图2装置。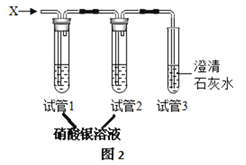
装置 | 试管1 | 试管2 | 试管3 |
现象 | _________ | 无明显变化 | 白色沉淀 |
试管3中发生的化学方程式为_______________;试管2中试剂的作用是_________。