题目内容
【题目】铁钉长期放置在潮湿的环境中会生锈(用Fe2O3表示铁锈)。取10g生锈的铁钉放入试管中,用CO还原,充分反应后,称得剩余固体质量为8.8g,请计算:
(1)生成CO2的质量为__________g;
(2)此铁钉中铁锈的质量分数为__________.
【答案】 3.3g 40%
【解析】(1)设生成CO2的质量为x。
Fe2O3 + 3CO ![]() 2Fe + 3CO2 反应前后固体的差量
2Fe + 3CO2 反应前后固体的差量
160 112 132 160-112
x 10g-8.8g
![]() =
=![]() ,解得x=3.3g
,解得x=3.3g
(2)设铁钉中所含氧化铁的质量为y。
Fe2O3 + 3CO ![]() 2Fe + 3CO2 反应前后固体的差量
2Fe + 3CO2 反应前后固体的差量
160 112 160-112
y 10g-8.8g
![]() =
=![]() ,解得y=4g
,解得y=4g
此铁钉中铁锈的质量分数为:![]() ×100%=40%
×100%=40%

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案【题目】实验室用铜辉矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备某种碱式碳酸铜【Cua(OH)b(CO3)cdH2O】的主要实验流程如下图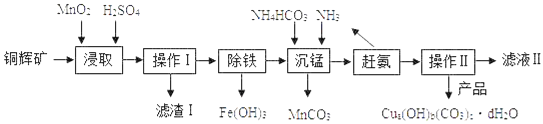
(1)实验室进行操作I和操作II时,用到的玻璃仪器有:玻璃棒、烧杯和__________。
(2)“浸取”步骤中发生反应(I、II),其中反应I为:2MnO2+Cu2S+□H2SO4=2MnSO4+2CuSO4+S↓+4H2O,在□中的化学计量数是________。
(3)“浸取”步骤中,另一反应II的化学方程式为________________。
(4)滤渣I的成分为MnO2、S和___________。
(5)已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
开始沉淀 | 7.5 | 2.7 | 5.2 | 8.3 |
完全沉淀 | 9.7 | 3.2 | 6.4 | 9.8 |
“除铁”步骤中,控制适宜的pH范围为_____________。