题目内容
【题目】小明、小芳二位同学为探究盐酸的化学性质,,做了如下实验:
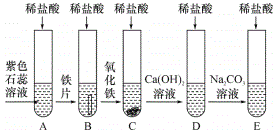
(1)若用pH试纸测该盐酸的pH值,则具体操作为___________。
(2)反应后试管C中一定含有的阳离子是___________(写离子符号);试管D中反应的化学方程式为_________________________________。
(3)小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成,过滤,得到白色沉淀和无色滤液。
小明同学欲探究无色滤液中的溶质成分:
小明同学分析得出无色滤液中一定不含HCl,理由是______________________。
(4)【提出问题】无色滤液的溶质是什么?
【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl和Na2CO3。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加少量①____________ | 无明显现象 | 猜想③成立 |
取少量滤液于试管中,滴加稀盐酸 | ②___________ |
【答案】 撕一小段pH试纸置于表面皿中,用洁净的玻璃棒蘸取该盐酸,沾在pH试纸上,再与标准比色卡对照读出pH值 ![]()
![]() 白色沉淀是
白色沉淀是![]() ,它能与
,它能与![]() 反应,因此无色滤液中一定不含HCl 碳酸钠溶液 产生无色气泡
反应,因此无色滤液中一定不含HCl 碳酸钠溶液 产生无色气泡
【解析】(1)若用pH试纸测盐酸的pH值,具体操作为撕一小段pH试纸置于表面皿中,用洁净的玻璃棒蘸取该盐酸,滴在pH试纸上,再与标准比色卡对照读出pH值。(2) Fe2O3 + 6HCl==2FeCl3 + 3H2O,因此反应后的试管中一定含有的阳离子是Fe3+。酸碱反应生成盐和水。(3)白色沉淀是CaCO3 ,它能与HCl反应,因此无色滤液中一定不含HCl。(4)三种猜想中都含有氯化钠,实验结论是猜想③成立,所以要证明CaCl2不存在,碳酸钠存在。Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑,所以加入碳酸钠溶液,无沉淀生成,说明CaCl2不存在;稀盐酸能与碳酸盐反应生成二氧化碳气体,因此再加入稀盐酸有气体生成,则猜想③成立。

 优加精卷系列答案
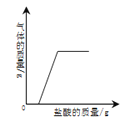
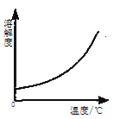
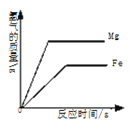
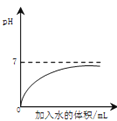
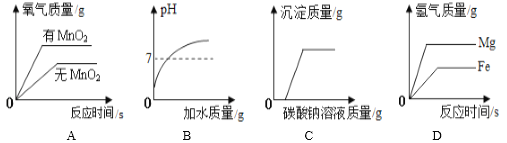
优加精卷系列答案【题目】下列四个图像反映了对应实验过程中相关量的变化,其中错误的是
|
|
|
|
A.部分变质的NaOH溶液中滴加稀盐酸 | B.HCl气体的溶解度受温度影响的变化曲线 | C.等质量的Mg粉和Fe粉与足量相同浓度的稀盐酸反应 | D.硫酸溶液稀释过程中pH的变化曲线 |
A. A B. B C. C D. D
【题目】化学就在我们身边,它与我们的生活息息相关。
(1)“化学——我们的生活,我们的未来”。
①我们常用洗涤剂清洗餐具上的油污,这是因为洗涤剂具有 __________功能。
②竹子可加工成具有吸附作用的物质,其作用与____________(填物质名称)相似。
③厨房中常用的调味品,能用来除水垢的酸_________________(填化学式)。
④城市生活中常用气体燃料煤气中含有毒气体一氧化碳,其燃烧的反应的化学方程式:__________。
(2)无土栽培是利用营养液栽培作物的一种方法.以下是栽培绿叶菜营养液配方。
肥料成分 | 用量(毫克/升) |
硝酸钙 | 1260 |
硝酸钾 | 255 |
磷酸二氢钠 | 350 |
硫酸镁 | 537 |
硫酸铵 | 235 |
①肥料成份中属于复合肥的是_____________。
②该营养液中存在的一种阳离子的符号_____。
③某硫酸铵溶液pH=4.5,则硫酸铵溶液显_________(填“酸性”、“碱性”或“中性”)。
④若在实验里配制10升该营养液,需要称取的硫酸镁的质量是____________毫克。