题目内容
【题目】某同学逛超市时发现食品添加剂中有“碳酸氢铵”,感觉很惊讶,“碳酸氢铵”是臭粉啊,怎么可以放进食品?于是开展了以下探究,请你帮助完成下列相关问题。
(1)查阅资料:
①食用级碳酸氢铵比较纯净,可作膨松剂,一般用在油炸食品中,水蒸食品中不用;
②常温常压下,1体积水约能溶解600体积氨气,其水溶液呈弱碱性。
③碱石灰是氧化钙和氢氧化钠的混合物。
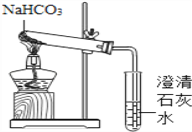
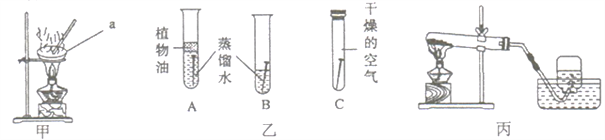
(2)产生疑惑:臭粉为何可以作膨松剂?为何一般适用于油炸食品而不适用于水蒸食品?(3)实验设计:实验装置如图,图一是检验装置,图二是收集装置,取适量碳酸氢铵分置于两试管中,按如图进行实验。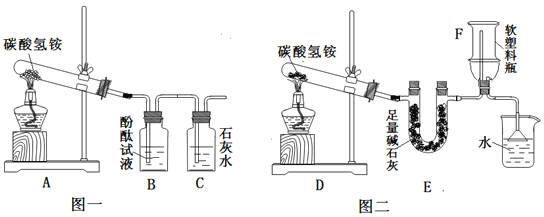
(4)现象与分析:
①图一:B中现象是__________,C中发生反应的化学方程式是_______________。
②图三:装置E的作用是_________,用F装置收集氨气,说明氨气具有_________性质,取下F,塞紧橡皮塞,用注射器向F中注入少量水,震荡,可看到的现象是______,拔出橡皮塞闻到氨味。
(5)解释与结论:①有臭味的碳酸氢铵添加到食品中,如果油炸,则含有的少量碳酸氢铵受热时完全分解,产生的气体使食品膨胀,且生成物可以迅速挥发而离开食品,没有残留物,其臭味会消失,碳酸氢铵受热发生反应的化学方程式是__________
②添加碳酸氢铵的食品如果水蒸,则__________。
通过上述探究该明白了:高纯度的碳酸氢铵可以作为食品添加剂,但同一食品添加剂并不适合所有食品,使用食品添加剂需严格控制用量。
【答案】 有气泡冒出,溶液变成红色 Ca(OH)2+CO2=====CaCO3↓+H2O 吸收水蒸气和二氧化碳 密度比空气小, 塑料瓶变瘪 NH4HCO3 ![]() NH3↑ + CO2 ↑+ H2O 部分氨气溶于水,影响口感
NH3↑ + CO2 ↑+ H2O 部分氨气溶于水,影响口感
【解析】本题考查了碳酸氢铵、二氧化碳的性质以及获得信息,处理信息的能力。
(4)①碳酸氢铵受热分解为氨气、水和二氧化碳,氨气溶于水形成氨水,氨水显碱性,能使无色的酚酞试液变红色; B装置内的观察到有气泡冒出,溶液变成红色;C中发生的反应是二氧化碳与氢氧化钙反应生成水和碳酸钙,化学方程式是Ca(OH)2+CO2=====CaCO3↓+H2O;
②碱石灰能吸收水蒸气,且能与二氧化碳发生化学反应,装置E的作用是吸收水蒸气和二氧化碳;用图示方法(瓶口向下排空气法)来收集氨气,说明氨气的密度比空气小;取下F,塞上橡皮塞,用注射器向F中注入少量水,氨气极易溶于水,瓶内的气压降低,会观察到塑料瓶变瘪;
(5)①碳酸氢铵受热分解为氨气、水和二氧化碳,化学方程式是:NH4HCO3 ![]() NH3↑ + CO2 ↑+ H2O;
NH3↑ + CO2 ↑+ H2O;
②氨气极易溶于水,若水蒸食品中添加了碳酸氢铵,受热分解后生成的氨气就会溶解在食品(或水)中,使食品有臭味,所以,添加碳酸氢铵的食品如果水蒸,碳酸氢铵分解生成氨气,氨气溶于水,则部分氨气溶于水,影响口感。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1