5.某同学对一种无色溶液进行鉴定实验,试根据他实验报告中的步骤和现象,填写相应的实验结论.(该溶液只含一种溶质)
(1)原无色溶液是H2SO4(写化学式)溶液.
(2)写出第二步实验中涉及的化学反应方程式:H2SO4+Ba(NO)3═BaSO4↓+2HNO3.
| 实验步骤 | 实验现象 | 结 论 |
| 第一步:取该溶液少许,向其中加少量铁粉 | 出现气泡,铁粉逐渐消失,溶液变成浅绿色 | 该溶液一定显酸性 |
| 第二步:再取该溶液少许,向其中加入硝酸钡Ba(NO3)2溶液,再加入足量的稀硝酸 | 有白色沉淀生成,该沉淀不溶于稀硝酸. | 白色沉淀为BaSO4 |
(2)写出第二步实验中涉及的化学反应方程式:H2SO4+Ba(NO)3═BaSO4↓+2HNO3.
3.某同学对酸碱盐的知识进行了以下的梳理.
(1)填写下表空格中的化学式:
反思:根据以上盐中的金属元素的排列,可以得出是依据金属的活动性顺序归纳整理的.
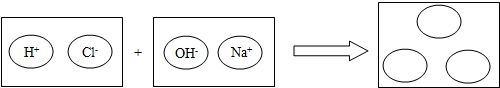
(2)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了如图.请你在如图的圆圈中填入适当的化学式或离子符号:
(1)填写下表空格中的化学式:
| 氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
| KCl | CaCl2 | NaCl | MgCl2 | AlCl3 | ZnCl2 | FeCl2 | CuCl2 |
(2)为理解稀盐酸和氢氧化钠两者之间发生反应的微观实质,绘制了如图.请你在如图的圆圈中填入适当的化学式或离子符号:

2.锂元素(元素符号为Li)及其所形成的化合物,在通讯和航空航天领域中具有极其重要的用途.它的化合物氢氧化锂(LiOH)是一种易溶于水的白色固体,有辣味,具有强碱性和腐蚀性.
(1)氢氧化锂属于碱(填“酸”、“碱”、“盐”或金属氧化物).
(2)写出氢氧化锂与硫酸(H2SO4)反应的化学方程式2LiOH+H2SO4═Li2SO4+2H2O;
(3)上表是部分物质的溶解性表,运用此溶解性表并结合你对复分解反应发生条件的理解,从表中选出一种盐,该盐能和LiOH发生复分解反应,请你写出该反应的化学方程式:2LiOH+CuSO4═Li2SO4+Cu(OH)2↓.
(1)氢氧化锂属于碱(填“酸”、“碱”、“盐”或金属氧化物).
(2)写出氢氧化锂与硫酸(H2SO4)反应的化学方程式2LiOH+H2SO4═Li2SO4+2H2O;
| OH- | CO32- | SO42- | NO3- | |
| Ba2+ | 溶 | 不 | 不 | 溶 |
| Cu2+ | 不 | 不 | 溶 | 溶 |
| Li+ | 溶 | 微溶 | 溶 | 溶 |
19. 将质量相等的铁片插入装有相同质量的稀H2SO4,FeSO4溶液、CuSO4溶液中,随着反应的进行中,三种溶液的质量变化如图所示,则a、b、c三条线表示的溶液为( )
将质量相等的铁片插入装有相同质量的稀H2SO4,FeSO4溶液、CuSO4溶液中,随着反应的进行中,三种溶液的质量变化如图所示,则a、b、c三条线表示的溶液为( )
0 166241 166249 166255 166259 166265 166267 166271 166277 166279 166285 166291 166295 166297 166301 166307 166309 166315 166319 166321 166325 166327 166331 166333 166335 166336 166337 166339 166340 166341 166343 166345 166349 166351 166355 166357 166361 166367 166369 166375 166379 166381 166385 166391 166397 166399 166405 166409 166411 166417 166421 166427 166435 211419
 将质量相等的铁片插入装有相同质量的稀H2SO4,FeSO4溶液、CuSO4溶液中,随着反应的进行中,三种溶液的质量变化如图所示,则a、b、c三条线表示的溶液为( )
将质量相等的铁片插入装有相同质量的稀H2SO4,FeSO4溶液、CuSO4溶液中,随着反应的进行中,三种溶液的质量变化如图所示,则a、b、c三条线表示的溶液为( )| A. | CuSO4、FeSO4、H2SO4 | B. | FeSO4、CuSO4、H2SO4 | ||
| C. | H2SO4、FeSO4、CuSO4 | D. | H2SO4、CuSO4、FeSO4 |



