17.除去下列物质中的杂质,所选用的方法正确的是( )
| 物质(括号内为杂质) | 搡作方法 | |
| A | CO2(HCl) | 先通过过量氧化钠溶液,再通过浓硫酸 |
| B | NaCl溶液(Na2CO3) | 加稀硫酸恰好不再产生气泡为止 |
| C | CuSO4溶液(H2SO4) | 加过量氧化铜粉末充分反应后过滤 |
| D | 铁粉(铜粉) | 加过量FeSO4溶液充分反应后过滤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
16.下列图示的“错误操作”,与对应选项“可能产生的后果”不一致的是( )
| A. |  试管破裂 | B. |  量取的液体偏少 | C. |  橡皮塞弹出 | D. |  灯内酒精燃烧 |
15. 在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行研究.
在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行研究.
探究一 M溶液中的溶质是什么?
【提出猜想】该组同学认为M溶液的溶质有两种可能:①是氢氧化钙,②是CaCl2.
【查阅资料】CaCl2,Ca(NO3)2水溶液呈中性.
【设计实验】同学们设计了如下方案并进行实验:
探究二 过滤后澄清滤液中会有哪些溶质?
【提出猜想】甲同学:NaOH;乙同学:NaOH、Ca(OH)2;
丙同学:含有NaOH、Ca(OH)2、Na2CO3;你认为可能含氢氧化钠和碳酸钠.
【分析讨论】经讨论,同学们一直认为丙同学的猜想肯定是不合理的.
【实验设计】(1)甲同学针对自己的猜想进行了如下实验.
你认为甲同学的实验结论是否正确不正确(填正确或不正确),理由是氢氧化钙和盐酸反应,也没有明显现象.
(2请你设计一个简单的实验来验证你的猜想是正确的:取样品,滴加过量的氯化钙,产生白色沉淀,再滴加酚酞,溶液变红色.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否过量或不足.
 在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行研究.
在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行研究.探究一 M溶液中的溶质是什么?
【提出猜想】该组同学认为M溶液的溶质有两种可能:①是氢氧化钙,②是CaCl2.
【查阅资料】CaCl2,Ca(NO3)2水溶液呈中性.
【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加酚酞溶液 | 溶液变红 | 猜想①正确,碳酸钠与M反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. |
【提出猜想】甲同学:NaOH;乙同学:NaOH、Ca(OH)2;
丙同学:含有NaOH、Ca(OH)2、Na2CO3;你认为可能含氢氧化钠和碳酸钠.
【分析讨论】经讨论,同学们一直认为丙同学的猜想肯定是不合理的.
【实验设计】(1)甲同学针对自己的猜想进行了如下实验.
| 实验步骤 | 实验现象 | 实验结论 |
| 取滤液于试管中,滴加少量的稀盐酸 | 无明显现象 | 猜想正确 |
(2请你设计一个简单的实验来验证你的猜想是正确的:取样品,滴加过量的氯化钙,产生白色沉淀,再滴加酚酞,溶液变红色.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否过量或不足.
14.为除去下列物质中的杂质(括号内为杂质),下列操作方法能达到目的是( )
| 选项 | 物质(杂质) | 操作方法 |
| A | CO2(H2O) | 将气体通过盛有火碱的干燥管 |
| B | Cu(CuO) | 通入足量氧气并加热 |
| C | CO2(CO) | 点燃 |
| D | FeCl2(CuCl2) | 加入足量铁屑,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
13.如图所示实验操作不正确的是( )
| A. |  蒸发 | B. |  取用固体粉末 | C. |  取用液体 | D. |  铁丝在O2中燃烧 |
10.某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,不溶于水,也不含氯化钠).把产生的所用氨气用足量的硫酸溶液完全吸收,同时测量120秒内硫酸溶液增加的质量,结果如表:
氯化铵与氢氧化钠加热条件下发生反应方程式为NH4Cl+NaOH=NaCl+H2O+NH3↑
氨气与硫酸反应的化学方程式为:2NH3+H2SO4=(NH4)2SO4
回答下列问题:
(1)产生氨气的质量1.7克.
(2)样品中氯化铵的质量分数为多少?
(3)反应后得到的氯化钠溶液的溶质质量分数为多少?(不考虑反应过程中水分的损失)
| 时间(S) | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 硫酸溶液增加的质量(g) | 0 | 0.7 | 1.0 | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
氨气与硫酸反应的化学方程式为:2NH3+H2SO4=(NH4)2SO4
回答下列问题:
(1)产生氨气的质量1.7克.
(2)样品中氯化铵的质量分数为多少?
(3)反应后得到的氯化钠溶液的溶质质量分数为多少?(不考虑反应过程中水分的损失)
8.利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2).每次取100g样品配制成溶液,向其中加入10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如下表所示:
(1)第三次加入的氢氧化钠溶液与粗盐中的MgCl2恰好完全反应.
(2)求粗盐的纯度(写出解题过程).
0 163297 163305 163311 163315 163321 163323 163327 163333 163335 163341 163347 163351 163353 163357 163363 163365 163371 163375 163377 163381 163383 163387 163389 163391 163392 163393 163395 163396 163397 163399 163401 163405 163407 163411 163413 163417 163423 163425 163431 163435 163437 163441 163447 163453 163455 163461 163465 163467 163473 163477 163483 163491 211419
| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 样品质量(g) | 100 | 100 | 100 | 100 |
| 氢氧化钠溶液质量(g) | 40 | 80 | 120 | 160 |
| 沉淀质量(g) | 2.9 | 5.8 | 8.7 | 8.7 |
(2)求粗盐的纯度(写出解题过程).
 某化工厂技术员小李分析氯化钡和氯化钠组成的产品中氯化钠的质量分数,取16.25g固体样品全部溶于143.6g水中,向所得溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图表示的曲线关系.
某化工厂技术员小李分析氯化钡和氯化钠组成的产品中氯化钠的质量分数,取16.25g固体样品全部溶于143.6g水中,向所得溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图表示的曲线关系.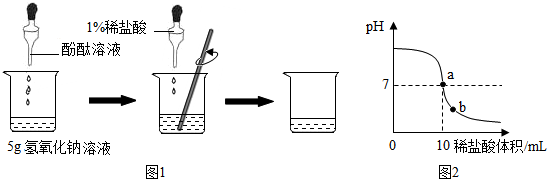
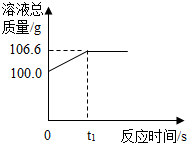 为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.
为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.