16. 硝酸钾和氯化钾在不同温度时的溶解度如下表所示.请回答下列问题:
硝酸钾和氯化钾在不同温度时的溶解度如下表所示.请回答下列问题:
(1)由表中数据分析可知,硝酸钾和氯化钾在某一温度时具有相同的溶解度x,则x的取值范围是34.0g<x<37.0g.
(2)如图所示,20℃时,将盛有饱和硝酸钾溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是下列中的BC(多项选择,填字母序号).
A.氢氧化钠固体 B.硝酸铵固体 C.冰块 D.食盐.
 硝酸钾和氯化钾在不同温度时的溶解度如下表所示.请回答下列问题:
硝酸钾和氯化钾在不同温度时的溶解度如下表所示.请回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| 溶解度/g | 硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| 氯化钾 | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
(2)如图所示,20℃时,将盛有饱和硝酸钾溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出.加入的物质可能是下列中的BC(多项选择,填字母序号).
A.氢氧化钠固体 B.硝酸铵固体 C.冰块 D.食盐.
13.向不锈钢材料中加入金属铬(Cr)能有效提高不锈钢的抗氧化性和耐腐蚀性.为比较金属铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,小明和小华进行了如下探究活动:
【猜想与假设】根据所学知识,猜想三种金属在金属活动性顺序中的相对位置关系:
猜想一:Al Cu Cr;猜想二:Cr Al Cu; 猜想三:Al Cr Cu.
【实验与探究】
(1)小明的实验:取大小相同的表面已打磨光滑的铝、铬、铜三种金属片
(2)小华的实验:
小华只选用了三种药品进行实验,也得出了三种金属在金属活动性顺序中的相对位置关系,你认为小华选择的三种药品可能是铝片、CrSO4溶液、铜片.
【总结与归纳】由上述实验得出比较金属活动性强弱的方法有:
①利用金属和酸反应情况进行比较;②利用金属和盐溶液反应情况进行比较.
(3)少数很不活泼的金属如金、银、铂等在地壳中以单质的形式存在,其余金属都以化合物的形式存在;镁能在空气中燃烧,而铁只能在氧气中或氧气含量更高的空气中燃烧.据此分析,比较金属的活泼性强弱还可以根据:
③金属在地壳中的存在形式;④金属跟空气反应的难易程度.
【猜想与假设】根据所学知识,猜想三种金属在金属活动性顺序中的相对位置关系:
猜想一:Al Cu Cr;猜想二:Cr Al Cu; 猜想三:Al Cr Cu.
【实验与探究】
(1)小明的实验:取大小相同的表面已打磨光滑的铝、铬、铜三种金属片
| 实验步骤 | 实验现象 | 解释与结论 |
| 分别取三支试管,向其中加入等质量、同浓度的稀硫酸,然后将铝、铬、铜三种金属分别插入三支试管中. | 铝片表面产生的气泡较快,铬片表面产生的气泡较缓慢,铜片表面无明显现象. | 所取稀硫酸需要等质量、同浓度的目的是控制变量. 猜想三成立. 铬与稀硫酸反应生成蓝色的硫酸亚铬(CrSO4)溶液,反应的化学方程式为H2SO4+Cr=CrSO4+H2↑. |
小华只选用了三种药品进行实验,也得出了三种金属在金属活动性顺序中的相对位置关系,你认为小华选择的三种药品可能是铝片、CrSO4溶液、铜片.
【总结与归纳】由上述实验得出比较金属活动性强弱的方法有:
①利用金属和酸反应情况进行比较;②利用金属和盐溶液反应情况进行比较.
(3)少数很不活泼的金属如金、银、铂等在地壳中以单质的形式存在,其余金属都以化合物的形式存在;镁能在空气中燃烧,而铁只能在氧气中或氧气含量更高的空气中燃烧.据此分析,比较金属的活泼性强弱还可以根据:
③金属在地壳中的存在形式;④金属跟空气反应的难易程度.
12.硝酸银溶液与一定量的镁锌合金充分反应后,过滤得到滤液和滤渣.为探究滤渣成分,将滤渣加入到盛有硫酸亚铁溶液的烧杯中,下列现象说明滤渣中一定没有镁的是( )
| A. | 烧杯中溶液质量不变 | B. | 烧杯中溶液质量增大 | ||
| C. | 烧杯中溶液颜色变浅 | D. | 烧杯中溶液颜色不变 |
11. (1)为探究CO2和NaOH是否发生了化学反应,小月设计了如图所示的A、B实验,验证CO2与NaOH溶液发生了化学反应.
(1)为探究CO2和NaOH是否发生了化学反应,小月设计了如图所示的A、B实验,验证CO2与NaOH溶液发生了化学反应.
①实验现象为:A中试管内液面上升;B中气球胀大.
②小莉提出质疑,她认为上述实验不严谨,其理由是二氧化碳能溶于水,要得到科学严谨的结论,仍利用A装置,补做的对比实验是把氢氧化钠溶液换成等体积的水进行试验.
(2)小明对反应后溶液中溶质的成分产生了兴趣,于是对其成分进行了探究.
【提出问题】反应后的溶液中的溶质含有什么.
【查阅资料】①Na2CO3+H2O+CO2═2NaHCO3 NaHCO3+NaOH═Na2CO3+H2O
②Ca(OH)2与 Na2CO3、NaHCO3均能反应且有白色沉淀生成;
③CaCl2与Na2CO3能反应且有白色沉淀生成,与NaHCO3不反应;
④NaHCO3溶液显碱性,可与酸反应生成CO2气体.
【提出猜想】
Ⅰ.Na2CO3;Ⅱ.NaOH、Na2CO3;
Ⅲ.NaHCO3;Ⅳ.Na2CO3和NaHCO3.
【设计实验】可供选择的试剂:Ca(OH)2溶液、CaCl2溶液、稀盐酸、酚酞试液.
【拓展应用】小燕认为A实验中存在安全隐患,理由是氢氧化钠溶液具有腐蚀性,取下橡皮塞时容易腐蚀皮肤.
 (1)为探究CO2和NaOH是否发生了化学反应,小月设计了如图所示的A、B实验,验证CO2与NaOH溶液发生了化学反应.
(1)为探究CO2和NaOH是否发生了化学反应,小月设计了如图所示的A、B实验,验证CO2与NaOH溶液发生了化学反应.①实验现象为:A中试管内液面上升;B中气球胀大.
②小莉提出质疑,她认为上述实验不严谨,其理由是二氧化碳能溶于水,要得到科学严谨的结论,仍利用A装置,补做的对比实验是把氢氧化钠溶液换成等体积的水进行试验.
(2)小明对反应后溶液中溶质的成分产生了兴趣,于是对其成分进行了探究.
【提出问题】反应后的溶液中的溶质含有什么.
【查阅资料】①Na2CO3+H2O+CO2═2NaHCO3 NaHCO3+NaOH═Na2CO3+H2O
②Ca(OH)2与 Na2CO3、NaHCO3均能反应且有白色沉淀生成;
③CaCl2与Na2CO3能反应且有白色沉淀生成,与NaHCO3不反应;
④NaHCO3溶液显碱性,可与酸反应生成CO2气体.
【提出猜想】
Ⅰ.Na2CO3;Ⅱ.NaOH、Na2CO3;
Ⅲ.NaHCO3;Ⅳ.Na2CO3和NaHCO3.
【设计实验】可供选择的试剂:Ca(OH)2溶液、CaCl2溶液、稀盐酸、酚酞试液.
| 实验操作 | 实验现象 | 实验结论 |
| 1取少量反应后溶液于试管中,加入足量的氯化钙溶液 | 产生白色沉淀 | 猜想Ⅲ不成立 |
| 2.将操作1所得混合物过滤,向滤液中加入氢氧化钙溶液 | 与白色沉淀生成 | 猜想Ⅳ成立 |
9.利用下图装置进行实验.实验前K1、K2、K3均已关闭.
(1)检查装置气密性:保持K1关闭,打开K2、K3,向B中加水至液面浸没下端导管口,用手捂住A瓶外壁,说明装置的左侧气密性良好的现象是B侧长导管中有气泡冒出,松手后,导管中液面上升,一段时间内高度不变;用其他方法检验右侧气密性良好.
(2)实验1中,加入H2O2溶液前,水中的白磷不燃烧;打开K1、K2和K3,将H2O2溶液加入A中,关闭K1,观察到白磷燃烧,产生大量的白烟,证明燃烧的条件之一是可燃物与氧气接触,B中发生反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(3)实验2中,打开K1、K2、K3,向A中注入适量的稀H2SO4,关闭K1,一段时间之后,用燃着的木条放在a口处,木条熄灭,关闭K2,上述实验操作的目的是排除B中的空气.此时,将装置B的a接口和Y型管的b接口连接,将注射器1中的溶液推入到B中,观察到气球明显变瘪;为进一步证明二氧化碳和氢氧化钠确实发生了反应,后续实验的操作及现象是将注射器2中的溶液推入到B中,观察到气球明显鼓起.
| 内容 装置 | 【实验1】探究燃烧条件 | 【实验2】探究CO2与NaOH反应 |
 | Ⅰ.A中加入少量的MnO2固体,分液漏斗中盛有H2O2溶液. Ⅱ.B中长导管口处放置盛有白磷的容器,注入80℃的热水,至液面浸没下端导管口. | Ⅰ.A中加入适量的Na2CO3固体,分液漏斗中盛放稀H2SO4溶液. Ⅱ.注射器1和2中分别是NaOH溶液和稀盐酸 |
(2)实验1中,加入H2O2溶液前,水中的白磷不燃烧;打开K1、K2和K3,将H2O2溶液加入A中,关闭K1,观察到白磷燃烧,产生大量的白烟,证明燃烧的条件之一是可燃物与氧气接触,B中发生反应的化学方程式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(3)实验2中,打开K1、K2、K3,向A中注入适量的稀H2SO4,关闭K1,一段时间之后,用燃着的木条放在a口处,木条熄灭,关闭K2,上述实验操作的目的是排除B中的空气.此时,将装置B的a接口和Y型管的b接口连接,将注射器1中的溶液推入到B中,观察到气球明显变瘪;为进一步证明二氧化碳和氢氧化钠确实发生了反应,后续实验的操作及现象是将注射器2中的溶液推入到B中,观察到气球明显鼓起.
8. 小组同学为了研究铁、锌、铜三种金属活动性顺序,进行了如下的探究.
小组同学为了研究铁、锌、铜三种金属活动性顺序,进行了如下的探究.
(1)甲组同学的方案如图所示:
①同学们认为甲组设计的方案能探究出三种金属的活泼性顺序,依据的现象是A中铁表面附着一层红色固体,溶液由蓝色变成浅绿色,B中无明显现象,写出A试管中化学方程式Fe+CuSO4═FeSO4+Cu.
②实验结束后,将A、B试管的剩余物倾倒至一个烧杯中,发现红色固体增多,说明在混合前,A试管溶液中的溶质一定有硫酸亚铁、硫酸铜.A、B两试管中的物质充分反应后,过滤,滤渣中一定有铜,为了确定可能有的物质是否存在,同学们设计了如下方案:
(2)乙组同学认为利用其他试剂也可以探究出三种金属的活动性顺序,下列试剂可行的是abcd.
a.Zn、Fe、CuSO4溶液、FeSO4溶液 b.Cu、Zn、FeSO4溶液
c.Fe、Cu、FeSO4溶液、ZnSO4溶液 d.Zn、Fe、Cu、稀H2SO4溶液.
 小组同学为了研究铁、锌、铜三种金属活动性顺序,进行了如下的探究.
小组同学为了研究铁、锌、铜三种金属活动性顺序,进行了如下的探究.(1)甲组同学的方案如图所示:
①同学们认为甲组设计的方案能探究出三种金属的活泼性顺序,依据的现象是A中铁表面附着一层红色固体,溶液由蓝色变成浅绿色,B中无明显现象,写出A试管中化学方程式Fe+CuSO4═FeSO4+Cu.
②实验结束后,将A、B试管的剩余物倾倒至一个烧杯中,发现红色固体增多,说明在混合前,A试管溶液中的溶质一定有硫酸亚铁、硫酸铜.A、B两试管中的物质充分反应后,过滤,滤渣中一定有铜,为了确定可能有的物质是否存在,同学们设计了如下方案:
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤渣于试管中,向其中滴加稀盐酸; | 发现产生气泡,溶液由无色变成浅绿色; | 可能有的物质一定存在 |
a.Zn、Fe、CuSO4溶液、FeSO4溶液 b.Cu、Zn、FeSO4溶液
c.Fe、Cu、FeSO4溶液、ZnSO4溶液 d.Zn、Fe、Cu、稀H2SO4溶液.
7.为探究铁、铜、银三种金属的活动性顺序,设计了A、B两个方案.请从两个方案中任选一个作答,若两个均作答,按方案A计分.
0 159256 159264 159270 159274 159280 159282 159286 159292 159294 159300 159306 159310 159312 159316 159322 159324 159330 159334 159336 159340 159342 159346 159348 159350 159351 159352 159354 159355 159356 159358 159360 159364 159366 159370 159372 159376 159382 159384 159390 159394 159396 159400 159406 159412 159414 159420 159424 159426 159432 159436 159442 159450 211419
| 方案A | 方案B |
 |  |
| (1)实验中发生反应的化学方程式为Fe+CuSO4=FeSO4+Cu. (2)实验中观察到的现象是①中无明显变化,②中铁片表面覆盖一层红色物质,溶液由蓝色变成浅绿色. (3)该方案能(填“能”或“不能”)验证三种金属的活动性. | (1)实验中发生反应的化学方程式为Fe+2HCl=FeCl2+H2↑. (2)实验中观察到的现象是①②中均无明显变化,③中有气泡冒出,溶液由无色变成浅绿色. (3)该方案不能(填“能”或“不能”)验证三种金属的活动性. |
 小红同学欲探究Fe、Cu以及未知金属R这三种金属的活动性顺序,进行了如下实验:
小红同学欲探究Fe、Cu以及未知金属R这三种金属的活动性顺序,进行了如下实验: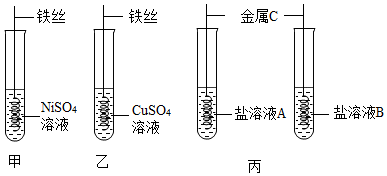
 金属钯是稀有的贵金属之一,金属钯制成的首饰不仅有迷人的光彩,而且经得住磨砺,现有银(Ag)、铂(Pt)、钯(Pd)三种金属制成的戒指,某实验小组利用它们来探究三种金属的活动顺序.
金属钯是稀有的贵金属之一,金属钯制成的首饰不仅有迷人的光彩,而且经得住磨砺,现有银(Ag)、铂(Pt)、钯(Pd)三种金属制成的戒指,某实验小组利用它们来探究三种金属的活动顺序.