13.下列几种符号有关说法正确的是( )
①CO2②2O③Ca2+ ⑤Na2SO3⑥ZnSO4.
⑤Na2SO3⑥ZnSO4.
①CO2②2O③Ca2+
 ⑤Na2SO3⑥ZnSO4.
⑤Na2SO3⑥ZnSO4.| A. | ①②中数字“2”表示的意义相同 | |
| B. | ③⑥中金属元素在化合物中的化合价相同 | |
| C. | ③④表示的是阳离子 | |
| D. | ⑤⑥中含有相同的原子团 |
11.食品安全无小事.下列做法符合食品安全要求的是( )
| A. | 用小苏打作焙制糕点发酵粉 | B. | 用霉变花生压榨食用油 | ||
| C. | 在猪饲料中添加瘦肉精 | D. | 用硫酸铜溶液制作返青粽叶 |
9.碳酸镁水合物是制备镁产品的中间体.
【制取MgCO3•3H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3•3H2O的方法如图1:

(1)沉淀过程的化学方程式为:
MgCl2+CO2+2NaOH+2H2O═MgCO3•3H2O↓+2NaCl.
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为c(填字母).
a.向卤水中滴加NaOH溶液,同时通入CO2
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表26-1所示.
表26-1 不同反应温度下的水合碳酸镁
则沉淀过程选择的温度为48.95℃,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀.
【测定MgCO3•3H2O的纯度】
利用如图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3•3H2O的纯度.

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收.
(2)C中反应生成CaCO3的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O;D中碱石灰的作用为防止空气中的CO2进入C装置干扰实验.
(3)下列各项措施中,不能提高测定准确度的是bc(填标号).
a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡
(4)实验中准确称取15.0g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO3•3H2O的纯度(写出计算过程).92.0%
(5)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有BaCO3的相对分子质量比CaCO3大,等质量的MgCO3•3H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小.
(6)若获取MgCO3•3H2O的样品中含有少量Mg5(OH)2(CO3)4•4H2O,则产品中镁元素的质量分数偏大(填“偏大”“不变”或“偏小”,下同),样品中MgCO3•3H2O的纯度偏大.
【制取MgCO3•3H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3•3H2O的方法如图1:

(1)沉淀过程的化学方程式为:
MgCl2+CO2+2NaOH+2H2O═MgCO3•3H2O↓+2NaCl.
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为c(填字母).
a.向卤水中滴加NaOH溶液,同时通入CO2
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表26-1所示.
表26-1 不同反应温度下的水合碳酸镁
| 温度(℃) | 产物 |
| 46.95 | MgCO3•3H2O |
| 47.95 | MgCO3•3H2O |
| 48.95 | MgCO3•3H2O |
| 49.95 | Mg5(OH)2(CO3)4•4H2O |
【测定MgCO3•3H2O的纯度】
利用如图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3•3H2O的纯度.

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收.
(2)C中反应生成CaCO3的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O;D中碱石灰的作用为防止空气中的CO2进入C装置干扰实验.
(3)下列各项措施中,不能提高测定准确度的是bc(填标号).
a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡
(4)实验中准确称取15.0g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO3•3H2O的纯度(写出计算过程).92.0%
(5)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有BaCO3的相对分子质量比CaCO3大,等质量的MgCO3•3H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小.
(6)若获取MgCO3•3H2O的样品中含有少量Mg5(OH)2(CO3)4•4H2O,则产品中镁元素的质量分数偏大(填“偏大”“不变”或“偏小”,下同),样品中MgCO3•3H2O的纯度偏大.
8.杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,为能充分利用钾资源,用饱和的Ca(OH)2溶液浸杂卤石制备硫酸钾,工艺流程如下:

已知:
(1)操作1的名称为过滤,所需的玻璃仪器有玻璃棒、烧杯、漏斗,玻璃棒的作用是引流.
(2)滤渣的主要成分有Mg(OH)2和CaSO4.
(3)“除杂”环节中,先加入a溶液(填字母,下同),经搅拌等操作后,过滤,再加入
c溶液调滤液pH至中性.
a.K2CO3 b.Na2CO3 c.稀硫酸 d.稀盐酸
(4)操作2的步骤是蒸发浓缩、降温结晶、过滤、洗涤.
(5)洗涤硫酸钾最好选用c.
a.30℃的水 b.饱和的硫酸钠溶液 c.饱和的硫酸钾溶液.

已知:
| 物质 | CaSO4 | K2SO4 | Mg(OH)2 |
| 溶解度/g(25℃) | 0.28 | 11.1 | 0.00084 |
(2)滤渣的主要成分有Mg(OH)2和CaSO4.
(3)“除杂”环节中,先加入a溶液(填字母,下同),经搅拌等操作后,过滤,再加入
c溶液调滤液pH至中性.
a.K2CO3 b.Na2CO3 c.稀硫酸 d.稀盐酸
(4)操作2的步骤是蒸发浓缩、降温结晶、过滤、洗涤.
(5)洗涤硫酸钾最好选用c.
a.30℃的水 b.饱和的硫酸钠溶液 c.饱和的硫酸钾溶液.
6. 如图为甲、乙、丙在水中的溶解度曲线图,下列说法正确的是( )
如图为甲、乙、丙在水中的溶解度曲线图,下列说法正确的是( )
 如图为甲、乙、丙在水中的溶解度曲线图,下列说法正确的是( )
如图为甲、乙、丙在水中的溶解度曲线图,下列说法正确的是( )| A. | 三种物质的溶解度都随温度升高而增大 | |
| B. | t1℃时,甲、丙两种物质的溶液中,溶质质量分数相等 | |
| C. | t2℃时,不可能制得相同质量分数的甲、乙、丙溶液 | |
| D. | t3℃时,甲的溶解度为80g |
5.CO2是目前应用广泛的超临界流体(一种介于气体和液体之间的状态),可用作某些物质的溶剂,以替代一些对环境和健康带来危害的有机溶剂.下列说法正确的是( )
| A. | 碳元素和氧元素只能组成二氧化碳 | |
| B. | 超临界流体二氧化碳分子不在运动 | |
| C. | 超临界流体CO2是一种新物质 | |
| D. | 超临界流体CO2是由二氧化碳分子构成的 |
4.如图是某化学反应的微观示意图,下列关于该反应前、后的说法不正确的是( )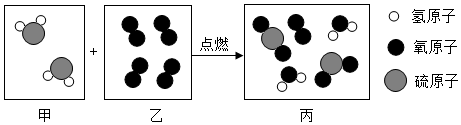
0 157054 157062 157068 157072 157078 157080 157084 157090 157092 157098 157104 157108 157110 157114 157120 157122 157128 157132 157134 157138 157140 157144 157146 157148 157149 157150 157152 157153 157154 157156 157158 157162 157164 157168 157170 157174 157180 157182 157188 157192 157194 157198 157204 157210 157212 157218 157222 157224 157230 157234 157240 157248 211419

| A. | 分子在化学变化中可以再分 | B. | 乙为氧化物 | ||
| C. | 反应后生成了两种新的化合物 | D. | 丙为混合物 |
 A~E是初中化学常见的物质,A、B、C、D是不同类别的物质,B、E属于同类物质.A可用于金属表面除锈,B可用来改良酸性土壤.“-”表示两种物质间能发生反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略).
A~E是初中化学常见的物质,A、B、C、D是不同类别的物质,B、E属于同类物质.A可用于金属表面除锈,B可用来改良酸性土壤.“-”表示两种物质间能发生反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略).