题目内容
4.如图是某化学反应的微观示意图,下列关于该反应前、后的说法不正确的是( )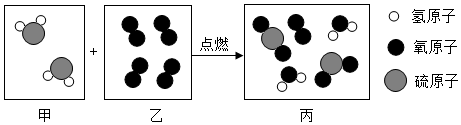
| A. | 分子在化学变化中可以再分 | B. | 乙为氧化物 | ||
| C. | 反应后生成了两种新的化合物 | D. | 丙为混合物 |
分析 根据反应过程图中的分子结构,判断反应物与生成物,确定该反应中各分子个数比和反应的化学方程式,进而由微粒的构成确定物质的类别等,据此分析解答.
解答 解:依据反应前后物质的分子结构可知反应物是氧气和硫化氢生成物是水和二氧化硫,则反应方程式为3O2+2H2S$\frac{\underline{\;点燃\;}}{\;}$2H2O+2SO2;
A、由微粒的变化可知,分子在化学变化中可以再分,故A正确;
B、由微粒的构成可知,乙为氧气,属于单质,故B错误;
C、由微粒的构成可知,反应后生成了两种新的化合物,故C正确;
D、由微粒的构成可知,丙是由不同种分子构成的,属于混合物,故D正确.
故选B.
点评 该题不仅考查了学生对化学知识的掌握情况,还考查了学生观察理解微观模型示意图的能力,从多方面考查了学生的综合能力.

练习册系列答案
相关题目
14.下列说法中正确的是( )
| A. | 铁制品在潮湿的空气中不易生锈 | |
| B. | “真金不怕火炼”说明黄金的熔点高 | |
| C. | 铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀 | |
| D. | 不锈钢的抗腐蚀性强于纯铁,硬度大于纯铁 |
15.下列现象中,前者为物理变化,后者属于化学变化的一组是( )
| A. | 蜡烛燃烧,葡萄酿酒 | B. | 汽车爆胎,石墨变为金刚石 | ||
| C. | 水果腐烂,蔗糖溶解 | D. | 玻璃破碎,鲜肉冷冻 |
12.下列物质中,属于氧化物的是( )
| A. | Al2O3 | B. | 碘酒溶液 | C. | HNO3 | D. | O2 |
19.国家卫计委发布《中国居民膳食指南(2016)》,倡导健康安全的生活理念.下列说法不合理的是( )
| A. | 鸡蛋含有丰富的蛋白质,是日常饮食中钙的来源之一 | |
| B. | 食用新鲜水果和蔬菜,可以为人体补充维生素 | |
| C. | 油脂是重要的营养物质,可大量摄入油脂 | |
| D. | 食物合理搭配,以保证各种营养均衡摄入 |
9.碳酸镁水合物是制备镁产品的中间体.
【制取MgCO3•3H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3•3H2O的方法如图1:

(1)沉淀过程的化学方程式为:
MgCl2+CO2+2NaOH+2H2O═MgCO3•3H2O↓+2NaCl.
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为c(填字母).
a.向卤水中滴加NaOH溶液,同时通入CO2
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表26-1所示.
表26-1 不同反应温度下的水合碳酸镁
则沉淀过程选择的温度为48.95℃,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀.
【测定MgCO3•3H2O的纯度】
利用如图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3•3H2O的纯度.

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收.
(2)C中反应生成CaCO3的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O;D中碱石灰的作用为防止空气中的CO2进入C装置干扰实验.
(3)下列各项措施中,不能提高测定准确度的是bc(填标号).
a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡
(4)实验中准确称取15.0g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO3•3H2O的纯度(写出计算过程).92.0%
(5)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有BaCO3的相对分子质量比CaCO3大,等质量的MgCO3•3H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小.
(6)若获取MgCO3•3H2O的样品中含有少量Mg5(OH)2(CO3)4•4H2O,则产品中镁元素的质量分数偏大(填“偏大”“不变”或“偏小”,下同),样品中MgCO3•3H2O的纯度偏大.
【制取MgCO3•3H2O】工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3•3H2O的方法如图1:

(1)沉淀过程的化学方程式为:
MgCl2+CO2+2NaOH+2H2O═MgCO3•3H2O↓+2NaCl.
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为c(填字母).
a.向卤水中滴加NaOH溶液,同时通入CO2
b.向NaOH溶液中滴加卤水,同时通入CO2
c.向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d.向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表26-1所示.
表26-1 不同反应温度下的水合碳酸镁
| 温度(℃) | 产物 |
| 46.95 | MgCO3•3H2O |
| 47.95 | MgCO3•3H2O |
| 48.95 | MgCO3•3H2O |
| 49.95 | Mg5(OH)2(CO3)4•4H2O |
【测定MgCO3•3H2O的纯度】
利用如图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3•3H2O的纯度.

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收.
(2)C中反应生成CaCO3的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O;D中碱石灰的作用为防止空气中的CO2进入C装置干扰实验.
(3)下列各项措施中,不能提高测定准确度的是bc(填标号).
a.在加入硫酸之前,应排净装置内的CO2气体
b.为了缩短实验时间,快速滴加硫酸
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在C装置左侧导管末端增添多孔球泡
(4)实验中准确称取15.0g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0g.请计算样品中MgCO3•3H2O的纯度(写出计算过程).92.0%
(5)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有BaCO3的相对分子质量比CaCO3大,等质量的MgCO3•3H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小.
(6)若获取MgCO3•3H2O的样品中含有少量Mg5(OH)2(CO3)4•4H2O,则产品中镁元素的质量分数偏大(填“偏大”“不变”或“偏小”,下同),样品中MgCO3•3H2O的纯度偏大.
16.合金的种类很多,用途非常广泛,黄铜是铜和锌的合金,它可以用来制造机器和电器的零件等.化学兴趣小组的同学欲测定实验室中某铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程.
称量20g粉末状黄铜样品放入烧杯中,量取60mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
试求:
(1)m的数值0.04.
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)
(3)所加稀硫酸溶液的溶质质量分数?(该温度下稀硫酸密度为1.066g/ml,计算结果保留至0.01%)
称量20g粉末状黄铜样品放入烧杯中,量取60mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
| 第一次 | 第二次 | 第三次 | |
| 加入稀硫酸的体积(ml) | 20 | 20 | 20 |
| 生成氢气的质量(g) | 0.04 | m | 0.02 |
(1)m的数值0.04.
(2)此黄铜样品中铜的质量分数是多少?(写出计算过程)
(3)所加稀硫酸溶液的溶质质量分数?(该温度下稀硫酸密度为1.066g/ml,计算结果保留至0.01%)
14.推理是化学学习中常用的思维方法,下列推理正确的是( )
| A. | 一氧化碳和二氧化碳组成元素相同,所以化学性质相同 | |
| B. | 化合物由不同种元素组成,所以不同种元素组成的物质都是化合物 | |
| C. | 可燃物燃烧温度需要达到着火点,所以可燃物温度达到着火点就可以燃烧 | |
| D. | 碱性溶液的pH值都大于7,所以pH值大于7的溶液一定是碱性溶液 |
 A、B、C、D、E、F都是初中化学常见的物质,其中B是植物进行光合作用的一种重要原料又称气肥,C是常见的食品干燥剂,它是金属氧化物.它们之间的关系如图所示.(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,有关反应条件和其他物质已略去.)
A、B、C、D、E、F都是初中化学常见的物质,其中B是植物进行光合作用的一种重要原料又称气肥,C是常见的食品干燥剂,它是金属氧化物.它们之间的关系如图所示.(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,有关反应条件和其他物质已略去.)