18. 某固态混合物中含有mgKNO3和若干不溶于水的杂质,将它加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如表:
某固态混合物中含有mgKNO3和若干不溶于水的杂质,将它加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如表:
(1)n的值为220.4g.
(2)75℃时所得溶液是否饱和不饱和(“不饱和”或“饱和”).
(3)若要ng水中恰好溶解mg硝酸钾即达到饱和,则温度最高应控制在60℃左右.
 某固态混合物中含有mgKNO3和若干不溶于水的杂质,将它加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如表:
某固态混合物中含有mgKNO3和若干不溶于水的杂质,将它加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如表:| 温度 | 10℃ | 40℃ | 75℃ |
| 未溶固体 | 261g | 175g | 82g |
(2)75℃时所得溶液是否饱和不饱和(“不饱和”或“饱和”).
(3)若要ng水中恰好溶解mg硝酸钾即达到饱和,则温度最高应控制在60℃左右.
17.维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同.下面是小明同学运用学到的实验方法测定橙汁、果味饮料中维生素C的含量.
【实验目的】测定不同饮料中维生素C的含量.
【实验原理】(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
(2)淀粉遇到碘水变蓝色.
【实验试剂】碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水
【实验过程】步骤1:在4支试管中分别盛有3.0mL的下列物质:
①蒸馏水,②标准维生素C溶液,③橙汁,④果味饮料.分别向4支试管中滴加2滴淀粉溶液.
步骤2:用4支相同的胶头滴管分别向①~④支试管中逐滴滴加碘水至刚好变色,并记录滴数.
【实验记录】
试回答下列问题:
(1)你认为小明测定的两种饮料中,③的维生素C的含量较高;
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由:不是多余的,因为测定标准维生素C溶液是确定维生素C含量的标准,以便估算出饮料中维生素C的浓度;
(3)化学实验需要控制变量.下列A B D(填序号)情况会影响到测定结果.
A.每次实验所用饮料的颜色不同
B.量取的被测试物质的体积不同
C.试管的大小不同
D.没有用同一规格的胶头滴管滴加碘水.
【实验目的】测定不同饮料中维生素C的含量.
【实验原理】(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
(2)淀粉遇到碘水变蓝色.
【实验试剂】碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水
【实验过程】步骤1:在4支试管中分别盛有3.0mL的下列物质:
①蒸馏水,②标准维生素C溶液,③橙汁,④果味饮料.分别向4支试管中滴加2滴淀粉溶液.
步骤2:用4支相同的胶头滴管分别向①~④支试管中逐滴滴加碘水至刚好变色,并记录滴数.
【实验记录】
| 测定物质 | ① | ② | ③ | ④ |
| 滴入碘水的数量(滴) | 1 | 8 | 15 | 5 |
(1)你认为小明测定的两种饮料中,③的维生素C的含量较高;
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由:不是多余的,因为测定标准维生素C溶液是确定维生素C含量的标准,以便估算出饮料中维生素C的浓度;
(3)化学实验需要控制变量.下列A B D(填序号)情况会影响到测定结果.
A.每次实验所用饮料的颜色不同
B.量取的被测试物质的体积不同
C.试管的大小不同
D.没有用同一规格的胶头滴管滴加碘水.
15.将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.该反应的化学方程式H2SO4+2NaOH═Na2SO4 +2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验方案及操作中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(2)其中实验方案错误的,其错误的原因是BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
(3)其中实验操作错误的,其错误的错误是pH试纸浸入溶液中.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出实验方案及操作中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(2)其中实验方案错误的,其错误的原因是BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
(3)其中实验操作错误的,其错误的错误是pH试纸浸入溶液中.
11. 某探究小组的同学用如图所示实验装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发生反应.
某探究小组的同学用如图所示实验装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发生反应.
(1)关闭K,通入二氧化碳,A、B中均无明显变化.继续通入二氧化碳.B中反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O. 从而证明了二氧化碳与氢氧化钠,氢氧化钙都能发生反应.
(2)同学们把(1)实验中反应后的A和B混合、过滤,并对滤液中的溶质成分进行探究.
【作出猜想】猜想一:NaOH
猜想二:Na2CO3和NaOH
猜想三:Ca(OH)2和NaOH
【进行实验】
【交流反思】
①有同学认为上述实验中,关闭时对二氧化碳通入的量要有一定的要求,否则不足以证明二氧化碳与氢氧化钠发生了反应,原因是二氧化碳能溶于水.
②还有同学认为上述猜想不完整,还有猜想四碳酸钠.
 某探究小组的同学用如图所示实验装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发生反应.
某探究小组的同学用如图所示实验装置进行实验,验证二氧化碳与氢氧化钠、氢氧化钙都能发生反应.(1)关闭K,通入二氧化碳,A、B中均无明显变化.继续通入二氧化碳.B中反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O. 从而证明了二氧化碳与氢氧化钠,氢氧化钙都能发生反应.
(2)同学们把(1)实验中反应后的A和B混合、过滤,并对滤液中的溶质成分进行探究.
【作出猜想】猜想一:NaOH
猜想二:Na2CO3和NaOH
猜想三:Ca(OH)2和NaOH
【进行实验】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取滤液少许于管中,滴加Na2CO3溶液 | 无明显现象 | 猜想 三不成立 |
| ②重新取滤液少许于管中,滴入过量 氯化钙溶液,在滴入2~3滴无色酚酞 | 有白色沉淀生成,溶液变红色 | 猜想二成立 |
①有同学认为上述实验中,关闭时对二氧化碳通入的量要有一定的要求,否则不足以证明二氧化碳与氢氧化钠发生了反应,原因是二氧化碳能溶于水.
②还有同学认为上述猜想不完整,还有猜想四碳酸钠.
10.一包白色粉末可能由碳酸钠、硫酸钠和氯化钠中的2种或3种组成.经实验得知其中肯定含有碳酸钠和硫酸钠,为了确定是否含有氯化钠,某同学设计了以下实验.请按该同学的思路填写下表:
0 150503 150511 150517 150521 150527 150529 150533 150539 150541 150547 150553 150557 150559 150563 150569 150571 150577 150581 150583 150587 150589 150593 150595 150597 150598 150599 150601 150602 150603 150605 150607 150611 150613 150617 150619 150623 150629 150631 150637 150641 150643 150647 150653 150659 150661 150667 150671 150673 150679 150683 150689 150697 211419
| 实验操作步骤 | 实验目的、现象及结论 |
| (1)取少量白色固体粉末,配成水溶液,向其中加入足量的稀酸A,A为H2SO4. | 除去Na2CO3 |
| (2)继续加入足量的B,B为Ba(NO3)2溶液,过滤. | 除去H2SO4 |
| (3)向(2)中的滤液中加入C,C为 AgNO3溶液 | 若有白色沉淀生成,证明原白色固体粉末中肯定含有氯化钠;否则不含氯化钠. |

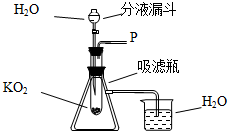 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.首先他将少量超氧化钾(KO2)粉末用脱脂棉包裹,没有任何变化(已知脱脂棉与超氧化钾不反应),然后向包有超氧化钾(KO2)粉末的脱脂棉上滴加少量的水,则脱脂棉迅速发生剧烈的燃烧(比在空气中燃烧还剧烈).小冬对此很感兴趣,于是,他和同学们进行探究.请你也参与他们的本次探究活动.