题目内容
18. 某固态混合物中含有mgKNO3和若干不溶于水的杂质,将它加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如表:
某固态混合物中含有mgKNO3和若干不溶于水的杂质,将它加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如表:| 温度 | 10℃ | 40℃ | 75℃ |
| 未溶固体 | 261g | 175g | 82g |
(2)75℃时所得溶液是否饱和不饱和(“不饱和”或“饱和”).
(3)若要ng水中恰好溶解mg硝酸钾即达到饱和,则温度最高应控制在60℃左右.
分析 (1)对比温度从10℃升至40℃再升温至75℃时,硝酸钾溶解度的改变及实验中未溶固体质量的改变,由二者的在
10℃和40℃的溶解度关系可得出m、n的值;
(2)判断实验中75℃时还有82g未溶解固体的成分,可判断此时所得KNO3溶液是否饱和;
(3)若要在n g水中恰好溶解m g 硝酸钾即饱和,由m、n的值计算出饱和时硝酸钾的溶解度,然后要曲线上查出对应温度.
解答 解:(1)根据硝酸钾溶解度曲线,温度从10℃升高至40℃时,硝酸钾的溶解度从20.7g增大到63.7g,溶解度增加了63.7g-20.7g=43g,
而实验中溶解硝酸的质量增加了261g-175g=86g,因此可得知实验中所用水n为200g;
200g水在10℃最多溶解硝酸钾20.7g×2=41.4g,则原固体混合物质量为41.4g+261g=302.4g;
温度从40℃升高75℃时,硝酸钾的溶解度增加了150g-63.7g=86.3g,
则200g水从40℃升温至75℃时可以多溶解硝酸钾的质量为86.3g×2=172.6g,
而实验中固体质量只减少了175g-82g=93g,说明所剩余82g固体不含硝酸钾,全部为不溶于水的杂质,则所取硝酸钾的质量=302.4g-82g=220.4g,
故答案为:220.4g;
(2)根据以上分析,由溶解度曲线可知200g水从40℃升温至75℃时,需要溶解硝酸钾的质量为86.3g×2=172.6g溶液才能继续饱和,但由表中数据可知只有93g硝酸钾继续溶解,因此此时的硝酸钾溶液为不饱和溶液,
故答案为:不饱和;
(3)n g水中恰好溶解m g硝酸钾,此时硝酸钾的溶解度=$\frac{220.4g}{200g}$×100g=110.2g,根据溶解度曲线可查得,此时温度约为60℃,
故答案为:60.
点评 此题是对溶解度计算的考查题,解题的关键是对图象及表格中数据的分析与应用,题目难度较大,应属竞赛题的类别.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案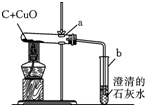 有一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.如表是实验中可能出现的现象与对应结论,请你填写表中空白处的相关内容:
有一包黑色粉末可能是由氧化铜和碳粉中的一种或两种物质组成,某学校科学小组为确定其成分,取少量该黑色粉末于烧杯中,加入过量稀硫酸,充分搅拌后观察.如表是实验中可能出现的现象与对应结论,请你填写表中空白处的相关内容:| 现象 | 结论 |
| 溶液呈蓝色,有黑色不溶物 | 含CuO、C |
| 溶液颜色无明显变化,有黑色不溶物 | 只含C |
①试管a中的化学方程式为C+2CuO$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑.
②氧化铜和碳反应属于置换反应(填基本反应类型).
③最能说明a试管中氧化铜和碳已完全反应的实验现象是b中的导管口不再产生气泡.
| A. | 正常人每天都应摄入一定量的蛋白质 | |
| B. | 做馒头时,常在发酵后的面团中加入适量的纯碱,使蒸熟的馒头疏松多孔 | |
| C. | 包装食品使用聚氯乙烯塑料袋,可以用加热的方法封口 | |
| D. | 厨房洗涤剂具有乳化功能,常用来除去餐具上的油污 |
【提出问题】滤液中除水外还含有哪些物质?
【猜想】
A.可能含有氢氧化钾、氯化钾和碳酸钾;
B.可能含有氢氧化钾、氯化钾;
C.可能含有氢氧化钾、氯化钾、碳酸钾和氯化钙.
你认为还可能是氢氧化钾、氯化钾和氯化钙(写出一种猜想).
【讨论】你认为C(填字母)猜想不合理,请说明理由.氯化钙和碳酸钾反应生成氯化钾和碳酸钙沉淀.
【实验设计】设计一个简单的实验,证明你的猜想正确.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴加适量的碳酸钾溶液 | 出现白色沉淀 | 猜想正确 |
 硝酸钾溶解度随温度变化的曲线如图所示:
硝酸钾溶解度随温度变化的曲线如图所示: 1860年,英国化学家法拉第在为少年儿童所作的化学讲座中做了一个有趣的“母子火焰”实验.回答下列问题:
1860年,英国化学家法拉第在为少年儿童所作的化学讲座中做了一个有趣的“母子火焰”实验.回答下列问题: