题目内容
12.市售塑料袋有的是用聚乙烯[(CH2CH2)n]制成,有的是用聚氯乙烯[(CH2CHCl)n]制成,通过查阅资料可知:(CH2CHCl)n+$\frac{5n}{2}$O2$\frac{\underline{\;点燃\;}}{\;}$ 2nCO2+nH2O+nHCl
其中n是上千或上万的数值;HCl气体极易溶于水,有刺鼻气味,其水溶液即是盐酸;鉴别盐酸的方法是加入AgNO3溶液,观察是否产生白色沉淀.
①通过点燃的方法可以鉴别聚乙烯和聚氯乙烯.如果塑料袋点燃时有强烈的刺鼻气味,这种塑料袋可能是由聚氯乙烯制成的.
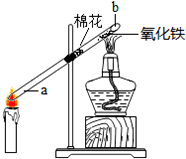
②某同学设计了如图所示实验来探究塑料燃烧的产物.

若A瓶燃烧的是聚氯乙烯塑料,在B瓶中可以看到的现象是试纸变红,瓶内壁有水雾(或瓶内有白雾)产生,C瓶中发出反应的化学方程式为HCl+AgNO3=AgCl↓+HNO3若A瓶中用的是聚乙烯塑料,则在C瓶中能观察到的现象是溶液中没有白色沉淀且有气泡冒出.
分析 聚氯乙烯这种塑料因含有氯元素,所以在燃烧时应有氯化氢产生,在检验氯化氢时,也就是检验氢离子和氯离子.
解答 解:聚氯乙烯因含氯元素所以在燃烧时,会有刺激性气味冒出.在检验聚氯乙烯反应的产物时,用紫色石蕊试纸检验有酸性气体产生.这时产生的气体还能使硝酸银溶液变浑浊,所以确定含有氯离子,有氯化氢气体产生.产生使澄清石灰水变浑浊的气体,说明产生了二氧化碳气体.而聚乙烯在燃烧时不产生氯化氢气体.
故答案为:①聚氯乙烯.
②试纸变红,瓶内壁有水雾(或瓶内有白雾)产生;
HCl+AgNO3=AgCl↓+HNO3;
溶液中没有白色沉淀且有气泡冒出.
点评 在有机物中碳元素完全燃烧转化为二氧化碳,不完全燃烧转化为一氧化碳,氢元素转化为水,而氯元素转化为氯化氢气体.

练习册系列答案
相关题目
3.在化学的学习中,同学们知道:聚乙烯塑料只含C、H两种元素,如用焚烧方法处理废弃塑料会造成大气污染.化学小组对聚乙烯塑料在空气中燃烧生成的碳的氧化物进行探究.
【提出猜想】A.只有CO2 B.只有CO C.既有CO又有CO2
【查阅资料】微量CO遇到浸有磷钼酸溶液的氯化钯黄色试纸,立即变蓝;而CO2遇该试纸不变色
【设计方案】化学兴趣小组在老师的指导下,设计下图所示实验,通过观察装置B、装置C的实验现象,验证猜想.

【实验探究】请你帮助他们写成实验报告.
【讨论】
(1)根据实验结论,从环保角度考虑,实验中应对尾气进行处理.处理方法是在实验装置的尾部加酒精灯将气体点燃,该处理方法利用了CO的可燃性.
(2)聚乙烯塑料在空气中燃烧,生成物中除了CO2、CO外,还应有的物质是水.
【提出猜想】A.只有CO2 B.只有CO C.既有CO又有CO2
【查阅资料】微量CO遇到浸有磷钼酸溶液的氯化钯黄色试纸,立即变蓝;而CO2遇该试纸不变色
【设计方案】化学兴趣小组在老师的指导下,设计下图所示实验,通过观察装置B、装置C的实验现象,验证猜想.

【实验探究】请你帮助他们写成实验报告.
| 实验步骤 | 实验现象 | 实验结论及化学方程式 |
| 点燃酒精灯加热,随即打开弹簧夹,通入干燥的空气. 观察装置B、装置C中的现象 | 装置B中的现象是:黄色试纸变蓝 装置C中的现象是:澄清石灰水变浑浊 | 聚乙烯塑料在空气中燃烧,生成碳的氧化物中,既有CO2,也有CO. 装置C中反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O |
(1)根据实验结论,从环保角度考虑,实验中应对尾气进行处理.处理方法是在实验装置的尾部加酒精灯将气体点燃,该处理方法利用了CO的可燃性.
(2)聚乙烯塑料在空气中燃烧,生成物中除了CO2、CO外,还应有的物质是水.
20.几位同学在实验室做木炭还原氧化铜的实验,实验完毕后,他们发现试管内仍有黑色固体物质存在.该试管中的黑色固体物质是什么?
【提出猜想】
小玉同学:木炭. 小兰同学:氧化铜. 小华同学:木炭和氧化铜.
【查阅资料】
木炭、铜都不与稀硫酸反应;CuO能与稀硫酸(H2SO4)反应生成硫酸铜和水.
【实验设计】
方案一:向盛有黑色固体的试管中加入足量的稀硫酸,充分振荡,静置后观察现象.
方案二:取少量该黑色固体在空气中灼烧,观察现象.
他们对“方案一”进行了分析讨论,达成了共识:若试管内溶液无色、还有黑色固体存在,证明
小玉同学的猜想正确. 若试管中溶液呈蓝色、无黑色固体,证明小兰 同学的猜想正确.若出现的现象是试管中溶液呈蓝色、有黑色固体,证明小华同学的猜想是正确的,发生反应的化学方程式为CuO+H2SO4═CuSO4+H2O.
他们按照“方案二”进行了实验操作,记录如下:
【提出猜想】
小玉同学:木炭. 小兰同学:氧化铜. 小华同学:木炭和氧化铜.
【查阅资料】
木炭、铜都不与稀硫酸反应;CuO能与稀硫酸(H2SO4)反应生成硫酸铜和水.
【实验设计】
方案一:向盛有黑色固体的试管中加入足量的稀硫酸,充分振荡,静置后观察现象.
方案二:取少量该黑色固体在空气中灼烧,观察现象.
他们对“方案一”进行了分析讨论,达成了共识:若试管内溶液无色、还有黑色固体存在,证明
小玉同学的猜想正确. 若试管中溶液呈蓝色、无黑色固体,证明小兰 同学的猜想正确.若出现的现象是试管中溶液呈蓝色、有黑色固体,证明小华同学的猜想是正确的,发生反应的化学方程式为CuO+H2SO4═CuSO4+H2O.
他们按照“方案二”进行了实验操作,记录如下:
| 实验现象 | 实验结论 |
| 黑色固体红热并逐渐减少,最后消失 | 该黑色固体是木炭. 反应的化学方程式是C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 |
17.维生素C是生命活动中不可缺少的营养物质,不同的饮料中维生素C的含量不同.下面是小明同学运用学到的实验方法测定橙汁、果味饮料中维生素C的含量.
【实验目的】测定不同饮料中维生素C的含量.
【实验原理】(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
(2)淀粉遇到碘水变蓝色.
【实验试剂】碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水
【实验过程】步骤1:在4支试管中分别盛有3.0mL的下列物质:
①蒸馏水,②标准维生素C溶液,③橙汁,④果味饮料.分别向4支试管中滴加2滴淀粉溶液.
步骤2:用4支相同的胶头滴管分别向①~④支试管中逐滴滴加碘水至刚好变色,并记录滴数.
【实验记录】
试回答下列问题:
(1)你认为小明测定的两种饮料中,③的维生素C的含量较高;
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由:不是多余的,因为测定标准维生素C溶液是确定维生素C含量的标准,以便估算出饮料中维生素C的浓度;
(3)化学实验需要控制变量.下列A B D(填序号)情况会影响到测定结果.
A.每次实验所用饮料的颜色不同
B.量取的被测试物质的体积不同
C.试管的大小不同
D.没有用同一规格的胶头滴管滴加碘水.
【实验目的】测定不同饮料中维生素C的含量.
【实验原理】(1)维生素C是一种无色易溶于水的有机物,能与碘水反应,使碘水褪色;
(2)淀粉遇到碘水变蓝色.
【实验试剂】碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水
【实验过程】步骤1:在4支试管中分别盛有3.0mL的下列物质:
①蒸馏水,②标准维生素C溶液,③橙汁,④果味饮料.分别向4支试管中滴加2滴淀粉溶液.
步骤2:用4支相同的胶头滴管分别向①~④支试管中逐滴滴加碘水至刚好变色,并记录滴数.
【实验记录】
| 测定物质 | ① | ② | ③ | ④ |
| 滴入碘水的数量(滴) | 1 | 8 | 15 | 5 |
(1)你认为小明测定的两种饮料中,③的维生素C的含量较高;
(2)有的同学认为测定物质标准维生素C溶液是多余的,你认为呢?请说明理由:不是多余的,因为测定标准维生素C溶液是确定维生素C含量的标准,以便估算出饮料中维生素C的浓度;
(3)化学实验需要控制变量.下列A B D(填序号)情况会影响到测定结果.
A.每次实验所用饮料的颜色不同
B.量取的被测试物质的体积不同
C.试管的大小不同
D.没有用同一规格的胶头滴管滴加碘水.
1.下列现象的微观解释中,不正确的是( )
| A. | 水蒸发为水蒸气,体积变大.温度升高,分子变大 | |
| B. | 3000L液化气在加压的情况下可装入20L的刚瓶中.-压强增大,分子间的间隔变小 | |
| C. | 香水、汽油要密封保存.-分子在不停的运动 | |
| D. | 湿衣服在阳光下比在阴凉处干得快.温度越高,分子运动的速度越快 |
 化学兴趣小组在老师指导下,对“蜡烛燃烧的产物”进行探究.
化学兴趣小组在老师指导下,对“蜡烛燃烧的产物”进行探究.