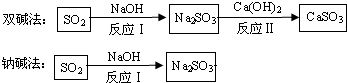
6.碳酸钠用途非常广泛,重要的化工原料.我国科学家侯德榜于1921 年创造了著名的“联合制碱法”,并在天津塘沽兴建了中国最早的制碱厂“永利制碱厂”.其主要生产过程如下:
(1)首先制取碳酸氢铵:NH3+CO2+H2O=NH4HCO3,该反应的基本反应类型为化合反应.
(2)第二步是用食盐与NH4HCO3反应.原料食盐来源于的渤海湾,从海水中提取粗盐.该粗盐主要含有氯化钠,还含有少量的氯化钙、氯化镁和硫酸钠.为得到纯净的食盐水将粗盐水进行如下净化过程:
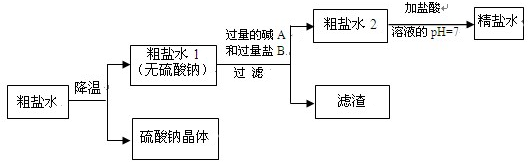
①从粗盐水中析出硫酸钠晶体其原理是降温结晶
②碱A 是由郊县的石灰石资源得到的,则过量的碱A 和粗盐水中的物质反应的方程式为Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
③加入的盐B 是,滤渣中含有的物质是Mg(OH)2、CaCO3
④查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl 在30℃时的溶解度如表所示:
请根据溶解度表所提供的信息,写出该步制碱法中复分解反应的化学方程式NH4HCO3+NaCl=NaHCO3↓+NH4Cl
(3)第三步加热碳酸氢钠:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
(1)首先制取碳酸氢铵:NH3+CO2+H2O=NH4HCO3,该反应的基本反应类型为化合反应.
(2)第二步是用食盐与NH4HCO3反应.原料食盐来源于的渤海湾,从海水中提取粗盐.该粗盐主要含有氯化钠,还含有少量的氯化钙、氯化镁和硫酸钠.为得到纯净的食盐水将粗盐水进行如下净化过程:

①从粗盐水中析出硫酸钠晶体其原理是降温结晶
②碱A 是由郊县的石灰石资源得到的,则过量的碱A 和粗盐水中的物质反应的方程式为Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
③加入的盐B 是,滤渣中含有的物质是Mg(OH)2、CaCO3
④查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl 在30℃时的溶解度如表所示:
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步加热碳酸氢钠:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
1.分析处理图表中的信息是学习化学的一种重要方法.
(1)表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
①40℃时,氯化钠的溶解度为36.6g.
②碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将 100g 的水加入 30g 碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到 30℃,该溶液的溶质质量分数为23.1% (计算结果精确到 0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液.
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式Fe+2HCl=FeCl2+H2↑.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是AC(填标号).
(1)表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
②碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将 100g 的水加入 30g 碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到 30℃,该溶液的溶质质量分数为23.1% (计算结果精确到 0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液.
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式Fe+2HCl=FeCl2+H2↑.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是AC(填标号).

20.如图是甲、乙两种固体物质在水中的溶解度曲线.下列说法不正确的是( )


| A. | 10℃时,甲、乙两种物质的饱和溶液浓度相同 | |
| B. | 保持 20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液 | |
| C. | 30℃时,将 40g 甲物质加人 50g 水中,充分溶解后溶液的质量为 80g | |
| D. | 10℃时,将两种饱和溶液升温至 30℃,溶液中溶质的质量分数都增大 |
18.下列推断正确的是( )
| A. | 在加压条件下,6000L 氧气可装入容积为 40L 的钢瓶中,由此推断氧气分子变小了 | |
| B. | 蔗糖在热水中的溶解速度更快,由此推断在受热情况下分子运动速率加快 | |
| C. | 中和反应生成盐和水,由此推断生成盐和水的反应一定是中和反应 | |
| D. | 碱能使酚酞试液变红,由此推断能使酚酞试液变红的物质一定是碱 |
17.我市盛产石灰石,主要成分是CaCO3.某同学为了测定石灰石中碳酸钙的质量分数进行了如下实验.取一定量的石灰石样品研碎和100g溶质质量分数为10%的稀盐酸放入烧杯中.在化学反应过程中对烧杯及其中的剩余物进行了五次称量,记录数据如表:(假设反应匀速进行;杂质不溶于水,也不与稀盐酸反应,烧杯的质量为25g)
请计算:
(1)表中的“m”为134.5g;
(2)该石灰石样品中碳酸钙的质量分数.(计算结果精确至0.1%)
0 148777 148785 148791 148795 148801 148803 148807 148813 148815 148821 148827 148831 148833 148837 148843 148845 148851 148855 148857 148861 148863 148867 148869 148871 148872 148873 148875 148876 148877 148879 148881 148885 148887 148891 148893 148897 148903 148905 148911 148915 148917 148921 148927 148933 148935 148941 148945 148947 148953 148957 148963 148971 211419
| 反应时间/s | 20 | 40 | 60 | 80 | 100 |
| 烧杯和药品质量/g | 137.8 | 135.6 | m | 134.5 | 134.5 |
(1)表中的“m”为134.5g;
(2)该石灰石样品中碳酸钙的质量分数.(计算结果精确至0.1%)

 已知A 与B、甲与乙均为初中化学常见的物质,且下列三种情况中的A 为甲烷、稀硫酸、硝酸银中的一种,其转化关系如图所示.
已知A 与B、甲与乙均为初中化学常见的物质,且下列三种情况中的A 为甲烷、稀硫酸、硝酸银中的一种,其转化关系如图所示.