题目内容
6.碳酸钠用途非常广泛,重要的化工原料.我国科学家侯德榜于1921 年创造了著名的“联合制碱法”,并在天津塘沽兴建了中国最早的制碱厂“永利制碱厂”.其主要生产过程如下:(1)首先制取碳酸氢铵:NH3+CO2+H2O=NH4HCO3,该反应的基本反应类型为化合反应.
(2)第二步是用食盐与NH4HCO3反应.原料食盐来源于的渤海湾,从海水中提取粗盐.该粗盐主要含有氯化钠,还含有少量的氯化钙、氯化镁和硫酸钠.为得到纯净的食盐水将粗盐水进行如下净化过程:
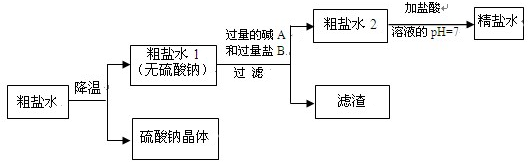
①从粗盐水中析出硫酸钠晶体其原理是降温结晶
②碱A 是由郊县的石灰石资源得到的,则过量的碱A 和粗盐水中的物质反应的方程式为Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓
③加入的盐B 是,滤渣中含有的物质是Mg(OH)2、CaCO3
④查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl 在30℃时的溶解度如表所示:
| 温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
| 30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
(3)第三步加热碳酸氢钠:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
分析 (1)根据化学反应反应物和生成物的种类即可判断反应的类型进行解答;
(2)①根据硫酸钠的溶解度随温度变化明显而氯化钠的溶解度受温度变化不明显进行解答;
②要除去粗盐中含有的氯化镁,可以加入氢氧化钙进行解答;
③要除去氯化钙可以加入碳酸钠,加入的碳酸钠能与过量的氢氧化钙反应,加入的B盐为碳酸钠进行解答;
④根据第二步食盐与NH4HCO3反应是复分解反应,以及碳酸氢钠的溶解度较小的信息书写方程式.
解答 解:(1)NH3+CO2+H2O=NH4HCO3中,反应物有三种,生成物是一种,所以属于化合反应;
(2)①硫酸钠的溶解度随温度变化明显而氯化钠的溶解度受温度变化不明显,所以从粗盐水中析出硫酸钠晶体其原理是降温结晶;
②要除去粗盐中含有的氯化镁,可以加入氢氧化钙生成氯化钙和氢氧化镁沉淀,化学方程式为:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;
③要除去氯化钙可以加入碳酸钠,加入的碳酸钠能与过量的氢氧化钙反应,加入的B盐为碳酸钠,反应后生成碳酸钙沉底和氢氧化镁沉淀,所以滤渣中含有的物质是Mg(OH)2、CaCO3;
④食盐与NH4HCO3反应是复分解反应,根据反应特点“两交换,价不变”判断,产物是氯化铵和碳酸氢钠,碳酸氢钠的溶解度较小,易结晶析出,可视为沉淀,化学方程式为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl.
故答案为:(1)化合反应;
(2)①降温结晶;
②Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓;
③Na2CO3,CaCO3、Mg(OH)2;
④NH4HCO3+NaCl=NaHCO3↓+NH4Cl.
点评 本题考查了碳酸钠的制取,完成此题,可以依据题干提供的信息结合已有的知识进行,难度较大.

练习册系列答案
相关题目
17.下列对有关实验异常现象分析合理的是( )
| A. | 铁丝在氧气中燃烧时集气瓶瓶底炸裂--红热的铁丝碰到集气瓶内壁 | |
| B. | 向澄清石灰水中通入二氧化碳无明显现象--可能是二氧化碳中混有氯化氢气体 | |
| C. | 将表面未处理的铝丝插入硫酸铜溶液中无明显现象--铝的金属活动性比铜弱 | |
| D. | 在粗盐提纯实验中过滤速率过慢--没用玻璃棒引流 |
1.分析处理图表中的信息是学习化学的一种重要方法.
(1)表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
①40℃时,氯化钠的溶解度为36.6g.
②碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将 100g 的水加入 30g 碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到 30℃,该溶液的溶质质量分数为23.1% (计算结果精确到 0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液.
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式Fe+2HCl=FeCl2+H2↑.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是AC(填标号).
(1)表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
②碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将 100g 的水加入 30g 碳酸钠中,充分搅拌后得到的是饱和溶液(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到 30℃,该溶液的溶质质量分数为23.1% (计算结果精确到 0.1%).
③10℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是碳酸钠饱和溶液.
(2)将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式Fe+2HCl=FeCl2+H2↑.如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是AC(填标号).

11.正确而规范的操作是保证化学实验安全和成功的基础.下列操作中正确的是( )
| A. | 给烧瓶、烧杯里的固体物质加热时,一定要垫上石棉网,防止受热不均而炸裂 | |
| B. | CO还原CuO实验结束时,先熄灭酒精灯,冷却后再停止通CO,防止红热的铜被氧化 | |
| C. | 稀释浓硫酸时,要将水沿烧杯内壁缓慢注入浓硫酸中,并用玻璃棒不断搅拌 | |
| D. | 测溶液的PH时,用玻璃棒蘸取待检液涂在湿润后的PH试纸上,再与比色卡对比读数 |
18.用下列实验操作可以完成两个实验,甲实验是除去粗盐中的难溶性固体杂质.乙实验是配制溶质质量分数为10%的氯化钠溶液.下列说法中正确的是( )


| A. | 甲实验的步骤是①④⑤,其中除杂质的关键步骤是蒸发 | |
| B. | 甲实验④中,玻璃棒的作用是搅拌加快过滤速度 | |
| C. | 乙实验若按②③①的步骤进行操作,所配溶液的浓度会偏小(水的密度为1g/cm3) | |
| D. | 乙实验②中,若左盘放砝码,右盘放药品,所称得的氯化钠一定比实际需要量少 |




