题目内容
3.完成下列化学方程式(1)碳在氧气中充分燃烧C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2
(2)双氧水与二氧化锰混合2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
(3)木炭与氧化铁在高温下反应3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2↑+4Fe.
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)碳在氧气中充分燃烧生成二氧化碳气体,反应的化学方程式为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)木炭与氧化铁在高温下反应生成铁和二氧化碳,反应的化学方程式为:3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2↑+4Fe.
故答案为:(1)C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;(2)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;(3)3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2↑+4Fe.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
相关题目
13.某学生分别用1g的铁屑、锌粒、镁片与足量的稀硫酸反应以制取氢气,完全反应所需时间与当地的金属价格如表所示.
请根据以上数据分析,实验室选用锌制取氢气,而不选用铁屑、镁片的原因.
| 物 质 | 所需时间 | 价 格 |
| 铁屑 | 约13900s | 10.00元/1000g |
| 锌粒 | 约50s | 20.00元/500g |
| 镁片 | 约20s | 10.80元/25g |
18.下列推断正确的是( )
| A. | 在加压条件下,6000L 氧气可装入容积为 40L 的钢瓶中,由此推断氧气分子变小了 | |
| B. | 蔗糖在热水中的溶解速度更快,由此推断在受热情况下分子运动速率加快 | |
| C. | 中和反应生成盐和水,由此推断生成盐和水的反应一定是中和反应 | |
| D. | 碱能使酚酞试液变红,由此推断能使酚酞试液变红的物质一定是碱 |
15.除去下列物质中所含的少量杂质,下表中除杂方法中不正确的是( )
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 氧化铜 | 氯化钠 | 加水溶解、过滤、洗涤干燥 |
| B | 氧气 | 水蒸气 | 通过盛有浓硫酸的洗气瓶 |
| C | 氯化钙溶液 | 稀盐酸 | 加入过量的石灰石,过滤 |
| D | CuSO4溶液 | FeSO4 | 加入足量铜粉,过滤 |
| A. | A | B. | B | C. | C | D. | D |
7.氧化镁在医药、建筑等行业应用广泛.以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶于酸)为原料制备高纯氧化镁的实验流程如图:
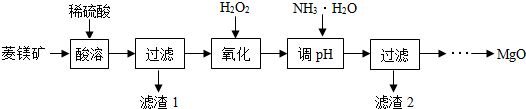
(1)酸溶之前要将矿石粉碎的目的是增大接触面积,使反应更快更充分.稀硫酸需要过量的目的是将碳酸镁和碳酸亚铁完全反应.酸溶步骤中碳酸镁溶解的反应方程式为MgCO3+H2SO4═MgSO4+CO2↑+H2O.
(2)已知Mg2+、Fe2+和Fe3+在溶液中遇到氨水均可以转化成难溶性碱沉淀,开始沉淀和沉淀完全的pH如表:
流程“氧化”一步中H2O2的作用是将溶液中的Fe2+转化成Fe3+,不能直接沉淀Fe2+的原因是防止Mg2+沉淀.
(3)加氨水调节溶液的PH范围为控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀.
(4)滤渣2的化学式是Fe(OH)3.

(1)酸溶之前要将矿石粉碎的目的是增大接触面积,使反应更快更充分.稀硫酸需要过量的目的是将碳酸镁和碳酸亚铁完全反应.酸溶步骤中碳酸镁溶解的反应方程式为MgCO3+H2SO4═MgSO4+CO2↑+H2O.
(2)已知Mg2+、Fe2+和Fe3+在溶液中遇到氨水均可以转化成难溶性碱沉淀,开始沉淀和沉淀完全的pH如表:
| Mg2+ | Fe2+ | Fe3+ | |
| 开始沉淀 | 9.4 | 7.9 | 2.7 |
| 沉淀完全 | 12.4 | 9.6 | 3.7 |
(3)加氨水调节溶液的PH范围为控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀.
(4)滤渣2的化学式是Fe(OH)3.
8.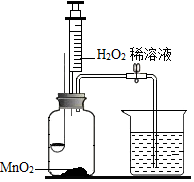 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
已知:白磷的着火点为 40℃.
(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;.
(2)实验中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是温度未达着火点、未与氧气接触; 推入H2O2溶液后,观察的现象是D(填序号).
A.燃烧匙内白磷、水中白磷均燃烧 B.燃烧匙内白磷、水中白磷均不燃烧
C.燃烧匙内白磷燃烧、水中白磷不燃烧 D.燃烧匙内白磷不燃烧、水中白磷燃烧
(3)实验2中,推入H2O2溶液后,观察到硫磺燃烧得更剧烈,发出蓝紫色 火焰,由此得出氧气的性质是支持燃烧;硫磺熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.该实验中,集气瓶内压强的变化过程是先变大后变小.
 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为 40℃.
| 内容 步骤 | 【实验 1】研究燃烧条件 | 【实验 2】研究氧气性质 |
Ⅰ | 烧杯中盛有 80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有 NaOH 溶液,燃烧匙中放入硫磺,点燃硫后迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(2)实验中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是温度未达着火点、未与氧气接触; 推入H2O2溶液后,观察的现象是D(填序号).
A.燃烧匙内白磷、水中白磷均燃烧 B.燃烧匙内白磷、水中白磷均不燃烧
C.燃烧匙内白磷燃烧、水中白磷不燃烧 D.燃烧匙内白磷不燃烧、水中白磷燃烧
(3)实验2中,推入H2O2溶液后,观察到硫磺燃烧得更剧烈,发出蓝紫色 火焰,由此得出氧气的性质是支持燃烧;硫磺熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.该实验中,集气瓶内压强的变化过程是先变大后变小.
