20.在水溶液中可以大量共存的一组离子是( )
| A. | H+、K+、OH- | B. | Na+、H+、HCO3- | C. | Fe3+、NO3-、OH- | D. | H+、NH4+、Cl- |
19. 烧杯中盛有CaCl2和HCl的混合溶液,向其中滴加Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法错误的是( )
烧杯中盛有CaCl2和HCl的混合溶液,向其中滴加Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法错误的是( )
 烧杯中盛有CaCl2和HCl的混合溶液,向其中滴加Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法错误的是( )
烧杯中盛有CaCl2和HCl的混合溶液,向其中滴加Na2CO3溶液,烧杯中溶液的pH与滴加溶液的质量关系如图所示.下列说法错误的是( )| A. | a点的溶质为HCl、NaCl | |
| B. | ab段反应产生大量气泡 | |
| C. | bc段反应的方程式为CaCl2+Na2CO3═2NaCl+CaCO3↓ | |
| D. | 取d点溶液滴加酚酞试液,溶液显红色 |
18.下列各组离子在水中能大量共存的是( )
| A. | Na+、H+、CO32- | B. | H+、K+、OH- | C. | H+、K+、SO42- | D. | Ag+、Ca2+、Cl- |
17.下列关于金属的说法正确的是( )
| A. | 合金的熔点通常比组成它们的纯金属高 | |
| B. | 赤铁矿炼铁的主要原理:CO+FeO$\frac{\underline{\;高温\;}}{\;}$CO2+Fe | |
| C. | 用CuSO4溶液、Fe和Ag可以验证Fe、Cu、Ag三种金属的活动性强弱 | |
| D. | 铁制品生锈产生的铁锈主要成分是Fe3O4 |
16.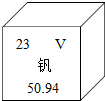 钒被誉为“合金的维生素”,钒元素的相关信息如图所示.下列有关钒的说法不正确的是( )
钒被誉为“合金的维生素”,钒元素的相关信息如图所示.下列有关钒的说法不正确的是( )
 钒被誉为“合金的维生素”,钒元素的相关信息如图所示.下列有关钒的说法不正确的是( )
钒被誉为“合金的维生素”,钒元素的相关信息如图所示.下列有关钒的说法不正确的是( )| A. | 属于金属元素 | B. | 原子序数为23 | ||
| C. | 原子核外电子数为23 | D. | 相对原子质量为50.94g |
15.下列叙述错误的是( )
| A. | 10mL酒精和10mL水混合后体积小于20mL,是因为分子变小了 | |
| B. | 空气中含量最多的气体是氮气 | |
| C. | 生活中常用煮沸的方法将硬水转化为软水 | |
| D. | 扑灭森林火灾时,可开挖防火隔离带,其目的是隔离可燃物 |
14.下列实验操作中,正确的是( )
| A. |  检查装置气密性 | B. |  除去CO中水蒸气 | C. |  测定溶液pH | D. |  稀释浓硫酸 |
11.南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质.为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发.正确的操作顺序是acdbe(填字母).加Na2CO3溶液的作用是除去氯化钙和过量试剂氢氧化钡.
(2)海水淡化.图1是一个简易的蒸馏法淡化海水的装置.证明得到的水是淡水的最简便方法是蒸干后没有晶体析出.
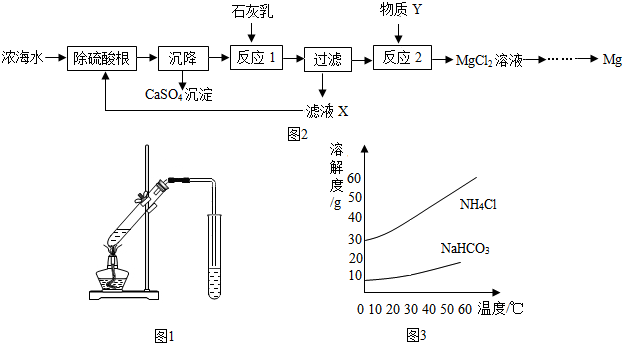
(3)海水制镁.浓海水中主要离子的浓度如上表.从浓海水中提取金属镁的一段工艺流程如图2所示:
写出反应1的化学方程式:Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓.滤液X中溶质的主要成分有CaCl2、NaCl(填化学式).将MgCl2溶液在一定条件下蒸发结晶、熔融电解可制得金属镁.则2L浓海水理论上可得到金属镁的质量为57.6g.
(4)海水“制碱”.氨碱法制纯碱是先向饱和食盐水通入氨气、二氧化碳生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱.写出生成NaHCO3和NH4Cl的化学方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;反应中生成NaHCO3和NH4Cl的质量比为84:53.5,NaHCO3和NH4Cl的溶解度曲线如图3所示.请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是生成的NaHCO3质量比NH4Cl多而溶解度比NH4Cl小,先达到饱和.
0 148258 148266 148272 148276 148282 148284 148288 148294 148296 148302 148308 148312 148314 148318 148324 148326 148332 148336 148338 148342 148344 148348 148350 148352 148353 148354 148356 148357 148358 148360 148362 148366 148368 148372 148374 148378 148384 148386 148392 148396 148398 148402 148408 148414 148416 148422 148426 148428 148434 148438 148444 148452 211419
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质.为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发.正确的操作顺序是acdbe(填字母).加Na2CO3溶液的作用是除去氯化钙和过量试剂氢氧化钡.
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |

(3)海水制镁.浓海水中主要离子的浓度如上表.从浓海水中提取金属镁的一段工艺流程如图2所示:
写出反应1的化学方程式:Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓.滤液X中溶质的主要成分有CaCl2、NaCl(填化学式).将MgCl2溶液在一定条件下蒸发结晶、熔融电解可制得金属镁.则2L浓海水理论上可得到金属镁的质量为57.6g.
(4)海水“制碱”.氨碱法制纯碱是先向饱和食盐水通入氨气、二氧化碳生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱.写出生成NaHCO3和NH4Cl的化学方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;反应中生成NaHCO3和NH4Cl的质量比为84:53.5,NaHCO3和NH4Cl的溶解度曲线如图3所示.请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是生成的NaHCO3质量比NH4Cl多而溶解度比NH4Cl小,先达到饱和.
 我国南海蕴藏着极为丰富的资源,在经济、国防上有重要意义.南海诸岛自古以来就是我国领土,我们要坚决捍卫在南海的主权.
我国南海蕴藏着极为丰富的资源,在经济、国防上有重要意义.南海诸岛自古以来就是我国领土,我们要坚决捍卫在南海的主权.