题目内容
9.将一些氧化铜粉末加入到盛有100克 14%的硫酸溶液的容器中,微热至氧化铜全部溶解.再向该蓝色溶液中加入铁粉16.8克,有气泡产生,充分反应后得到气体0.036克;再把容器中混和物过滤、干燥,仍得到固体物质16.8克.求:(1)最后的固体物质中有多少克铁粉?
(2)原加入的氧化铜质量是多少克?
(3)最后得到的溶液的质量分数是多少?
分析 (1)根据氧化铜和硫酸反应生成硫酸铜和水,硫酸铜和铁会生成硫酸亚铁和铜,铁和硫酸反应生成硫酸亚铁和氢气,然后依据反应前后固体质量不变进行分析;
(2)最后生成的溶质是FeSO4,它是由两部分生成的.第一部分与CuSO4反应得到的FeSO4,第二部分是铁与剩余硫酸生成的FeSO4,反应后溶液中总共含有FeSO4为两部分的质量和;利用铁和硫酸铜反应以及氧化铜的关系求出氧化铜的质量即可.
(3)根据质量守恒定律,反应后所得溶液总质量=100g稀硫酸+氧化铜的质量+铁的质量-析出的铜的质量(与铁的质量相等)-氢气质量,由于参加反应铁的质量与析出固体的质量相等,所以反应后所得溶液的总质量=100g稀硫酸+氧化铜的质量-氢气质量.则最后得到溶液的质量分数为生成FeSO4的总质量与反应后所得溶液总质量的比.
解答 解:(1)氧化铜和硫酸反应生成硫酸铜和水,硫酸铜和铁会生成硫酸亚铁和铜,铁和硫酸反应生成硫酸亚铁和氢气,所以最后的固体物质中有铁粉的质量为0.
(2)设与硫酸反应的铁的质量为x,与硫酸铜反应的铁的质量为y,固体增加质量为m
Fe+H2SO4═FeSO4+H2↑ 固体减少
56 56
x x
Fe+CuSO4═FeSO4+Cu 固体质量增加
56 64 8
y m
$\frac{56}{y}=\frac{8}{m}$
m=$\frac{y}{7}$
所以x+y=16.8①
化学反应前后固体质量不变,所以 x=$\frac{y}{7}$
由①②可知,x=2.1g,y=16.8g-2.1g=14.7g
设氧化铜质量为z,
Fe--CuSO4---CuO
56 80
14.7g z
$\frac{56}{14.7g}=\frac{80}{z}$
z=21g
(2)铁和硫酸反应生成硫酸亚铁质量为w,生成氢气为a
Fe+H2SO4═FeSO4+H2↑
56 152 2
2.1g w a
$\frac{56}{2.1g}=\frac{152}{w}=\frac{2}{a}$
w=5.7g
a=0.075g
铁和硫酸铜反应生成硫酸亚铁质量为h
Fe+CuSO4═FeSO4+Cu 固体质量增加
56 152
14.7g h
$\frac{56}{14.7g}=\frac{152}{h}$
h=39.9g
$\frac{5.7g+39.9g}{100g+21g-0.075g}$×100%=37.7%.
最后的固体物质中有16.8g-
答:(1)最后的固体物质中铁粉质量为0.
(2)原加入的氧化铜质量是21g;
(3)最后得到的溶液的质量分数是37.7%.
点评 分析固体质量不变的原因是解决本题的关键:要使加入的铁粉和得到的固体质量相等必须使硫酸消耗多余的Fe,且消耗铁粉的质量与置换出铜固体增加的质量相等.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案| A. | 增加砝码 | B. | 增加药品 | C. | 减少砝码 | D. | 减少药品 |
(1)猜想:VC可能具有酸性.
(2)实验方案:请帮助他们把两种实验方案的缺失内容填完整:
| 实验内容 | 实验现象 |
| 将维生素C药片研碎,加入蒸馏水配成溶液,取溶液少许注入试管,然后滴入几滴试液,观察现象. | 溶液变成红色,说明维生素C具有酸性. |
| 将维生素C药片研碎,加入蒸馏水配成溶液,再取少许氢氧化钠溶液注入试管并滴入几滴无色酚酞试液,然后逐滴加入维生素C溶液,观察现象. | 如氢氧化钠溶液颜色,说明说明维生素C具有酸性 |
A.Mg B.KCl C.NaOH D.CuSO4
(4)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,放置时间长短是否对维生素C的含量产生影响.他设计了如下实验方案:
【查阅资料】①VC能与碘反应.②碘能使淀粉溶液变成蓝色
Ⅰ:把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个烧杯中;
Ⅱ:取两支盛有2mL蓝色碘的淀粉溶液的试管,分别滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录滴数如表:
| 汁液 | 新鲜西红柿的汁液 | 放置一周的西红柿的汁液 |
| 滴数 | 12 | 20 |
①你认为西红柿中维生素C含量高的是新鲜西红柿的汁液
②你从中得到的启示是西红柿等蔬菜、水果应该食用新鲜的.
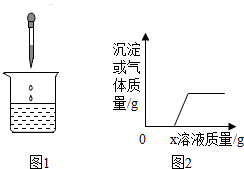 向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )| 烧杯中的物质 | x溶液 | |
| A | 氯化钠和碳酸氢钠溶液 | 稀盐酸 |
| B | 需硫酸和稀盐酸 | 氯化钡溶液 |
| C | 黄铜粉末 | 稀盐酸 |
| D | 稀盐酸和硫酸镁溶液 | 烧碱溶液 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 该粉末可能是CaCO3 | B. | 该粉末一定是碱 | ||
| C. | 该粉末可能是Na2CO3 | D. | 该粉末中一定含有CO32- |

【查阅资料】无水硫酸铜为白色固体,遇水变成蓝色.请根据资料回答:
(1)在实验中,甲装置的作用是除水.
(2)准确称取完全反应前后装置丙和丁的质量如表:
| 装置丙 | 装置丁 | |
| 反应前 | 48.8克 | 161.2克 |
| 反应后 | 46.5克 | 163.9克 |
(3)小明根据装置丙的质量变化计算,发现小丽结果偏大.请分析导致这一结果的原因可能是B.
A.装置的气密性不好 B.空气中的水分被丁处浓硫酸吸收
C.通入的氢气量不足 D.氧化铜没有完全被还原.
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 2 | 30 | 20 | 10 |
| 反应后的质量/g | m | 39 | 5 | 16 |
| A. | 该反应是化合反应 | |
| B. | 甲是该反应的催化剂 | |
| C. | 反应过程中乙、丙变化的质量比为3:5 | |
| D. | 丙可能是单质 |

