题目内容
4.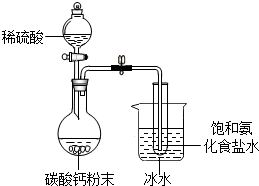 某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠.
某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠.【查阅资料】:
(1)实验原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl(向饱和粗食盐水中通入足量氨气至饱和,然后通入二氧化碳,得到溶解度较小的碳酸氢钠白色沉淀和氯化铵溶液).
(2)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
(3)实验装置如图
【实验步骤】:
(1)准备:称取8g 粗盐,加入到30mL的饱和氨水中,配制饱和氨化粗盐水于大试管中.如图搭好装置并检查气密性.称取50g碳酸钙粉末于圆底烧瓶中,再量取100mL的稀硫酸于玻璃容器中.
(2)制备:将装有配制好的饱和氨化粗盐水的试管浸入冰水中,向其中通入二氧化碳气体约5分钟看到沉淀,约10分钟时产生大量白色沉淀.你觉得烧杯中冰水的主要作用是降温有利于NaHCO3晶体析出.实验结束后将产物过滤,滤渣洗涤、晾干.取少量样品与氢氧化钠溶液混合后加热,用湿润的红色石蕊试纸检验,不变色即可证明滤渣不含铵盐;剩余固体滤渣放入蒸发皿中直接灼烧,还需要的玻璃仪器是玻璃棒,所起的作用搅拌均匀受热.最后将蒸发皿中白色固体冷却既得纯碱碳酸钠.
【反思与拓展】:
(3)实验室常选用大理石和稀盐酸制取二氧化碳气体,通常不用稀硫酸是因为生成微溶CaSO4阻止反应持续进行.本实验中用碳酸钙粉末和稀硫酸也能得到稳定持续的二氧化碳气体,因为接触面积变大加快了反应.写出化学方程式CaCO3+H2SO4═CaSO4+CO2↑+H2O.
(4)假设实验过程中50g 碳酸钙粉末和100mL稀硫酸在圆底烧瓶中能恰好完全反应(二氧化碳气体全部逸出),试计算:(写出计算过程)
①生成二氧化碳的质量;
②若通入大试管的二氧化碳实际利用率为50%,则最多可以生成碳酸氢钠多少g?
分析 (1)制取气体之前需要检查气密性;
(2)根据NaHCO3的溶解度分析,根据铵根离子的检验分析,结合结合蒸发操作分析;
(3)稀硫酸和大理石反应,会生成硫酸钙,覆在大理石表面,阻止进一步的反应; 接触面积变大可以加速反应进行;
(4)由碳酸钙的质量根据碳酸钙与硫酸反应的化学方程式可以计算出生成二氧化碳的质量和碳酸氢钠的质量.
解答 解:(1)制取气体之前需要检查气密性;
(2)NaHCO3的溶解度随温度的升高而增大,冰水降温有利于NaHCO3晶体析出;铵盐与氢氧化钠反应生成氨气,可以使用湿润的红色石蕊试纸来检验;蒸发操作中玻璃棒的作用是搅拌使物质均匀受热;
(3)稀硫酸和大理石反应,会生成硫酸钙,覆在大理石表面,阻止进一步的反应;碳酸钙粉末和稀硫酸也能得到稳定持续的二氧化碳气体,是因为接触面积变大加快了反应,化学方程式为CaCO3+H2SO4═CaSO4+CO2↑+H2O;
(4)设生成二氧化碳的质量为x,最多可以生成碳酸氢钠质量为y.
CaCO3+H2SO4═CaSO4+CO2↑+H2O
100 44
50g x
$\frac{100}{50g}$=$\frac{44}{x}$
x=22g
NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl
44 84
22g×50% y
$\frac{44}{22g×50%}$=$\frac{84}{y}$
y=21g
故答案为:(1)检查气密性;
(2)降温有利于NaHCO3晶体析出; 湿润的红色石蕊试纸; 玻璃棒; 搅拌均匀受热
(3)生成微溶CaSO4阻止反应持续进行; 接触面积变大加快了反应;
CaCO3+H2SO4═CaSO4+CO2↑+H2O;
(4)22g;21g
点评 本题充分考查利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力、分析解决问题的能力,难度稍大.

 阅读快车系列答案
阅读快车系列答案 根据图甲、乙、丙三种物质的转化关系,推测甲为( )
根据图甲、乙、丙三种物质的转化关系,推测甲为( )| A. | 铜 | B. | 碳酸钠 | C. | 氧化铜 | D. | 氢氧化钡 |
| A. | 炸薯条 | B. | 水果糖 | C. | 饼干 | D. | 咸鸭蛋 |
| A. |  等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应 | |
| B. |  向H2SO4和MgSO4的混合溶液中滴加NaOH溶液 | |
| C. |  向pH=13的氢氧化钠溶液中不断加入稀硫酸 | |
| D. |  化学反应中,原子总数随时间的变化 |
| A. | 煤 | B. | 氢气 | C. | 石油 | D. | 天然气 |
| A. | 用食盐腌渍菜、鱼、肉、蛋的方法可以延长食物的保存时间 | |
| B. | 用洗涤剂乳化油脂的方法除去餐具上的油污 | |
| C. | 用喷漆的方法防止自行车链条锈蚀 | |
| D. | 用沉淀、过滤、吸附等净化方法,可以使浑浊的水变澄清 |
 某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:
某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则: