题目内容
13. 某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:
某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:①溶液甲中一定含Al(NO3)3和 Zn(NO3)2
②固体乙中一定含Ag,可能含有Cu和Zn
③若溶液甲呈蓝色,则溶液甲一定含Al(NO3)3、Zn( NO3)2、Cu(NO3)2和AgNO3
④若向固体乙上滴加盐酸无气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3)2
上述四种说法正确的个数为( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 根据在金属活动性顺序中,排在前面的金属可以把位于它后面的金属从其盐溶液中置换出来,可简记为“前置后,盐可溶”.
解答 解:金属活动性Al>Zn>Cu>Ag,所以锌粉优先与AgNO3发生反应,铜粉后与AgNO3发生反应,但是铜粉和锌粉都不能和Al(NO3)3发生反应,Al(NO3)3一定在溶液中;
①锌粉优先与AgNO3发生反应生成硝酸锌和银,铜粉和锌粉都不能和Al(NO3)3发生反应,所以溶液中一定有Al(NO3)3和Zn(NO3)2,故说①法正确;
②锌粉优先与AgNO3发生反应生成硝酸锌和银,固体乙中一定含有Ag,可能有Cu和Zn,故②说法正确;
③若溶液甲是蓝色,说明铜已经与AgNO3发生反应,而锌已经全部反应,溶液甲一定含有Al(NO3)3、Zn(NO3)2和Cu(NO3)2,AgNO3的存在不能确定,故③说法不正确;
④向固体乙上滴加盐酸无气泡产生,说明固体中没有锌,锌可能过量\适量或不足,不能说明AgNO3和Cu(NO3)2的存在.故④说法不正确;
由上述分析可知,正确的是2个
故选:B.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.灼烧氯化钠时火焰的颜色呈( )
| A. | 红色 | B. | 绿色 | C. | 黄色 | D. | 紫色 |
8.说法正确的是( )
| A. | 锌粒与盐酸反应比铁片与盐酸反应要剧烈,故锌比铁活泼 | |
| B. | 酸中一定含有氢元素,所以含氢元素的物质一定是酸 | |
| C. | 燃烧一般都伴随发光和放热现象,所以有发光和放热现象的变化都是燃烧 | |
| D. | 置换反应生成单质和化合物,但有单质和化合物生成的反应不一定是置换反应 |
18.生活中常见的物质属于纯净物的是( )
| A. | 蒸馏水 | B. | 白醋 | C. | 牛奶 | D. | 葡萄酒 |
5.实验操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
 广州市食品监督管理局贡布里餐饮环节一季度食品抽检数据,在抽检的18批次米及米制品中,有8批次产品镉超标.镉是银白色有金属光泽的金属,镉在潮湿空气中缓慢氧化并失去金属光泽,加热时表面形成氧化物层,氧化镉和强氧化镉的溶解度都很小,它们溶于酸,但不溶于碱,认真阅读以上材料回答一下问题:
广州市食品监督管理局贡布里餐饮环节一季度食品抽检数据,在抽检的18批次米及米制品中,有8批次产品镉超标.镉是银白色有金属光泽的金属,镉在潮湿空气中缓慢氧化并失去金属光泽,加热时表面形成氧化物层,氧化镉和强氧化镉的溶解度都很小,它们溶于酸,但不溶于碱,认真阅读以上材料回答一下问题: .该化学式方程式中“
.该化学式方程式中“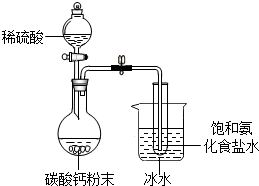 某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠.
某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠. ”表示氮原子、“
”表示氮原子、“ ”表示氧原子,可以表示甲分子的图示是( )
”表示氧原子,可以表示甲分子的图示是( )


