题目内容
12. (1)实验室现有质量分数为98%(密度:1.84g/cm3)的浓硫酸,欲将这种浓硫酸稀释为19.6%的稀硫酸184g,要这种浓硫酸体积为mL;
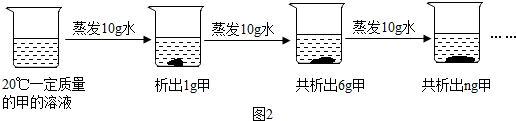
(1)实验室现有质量分数为98%(密度:1.84g/cm3)的浓硫酸,欲将这种浓硫酸稀释为19.6%的稀硫酸184g,要这种浓硫酸体积为mL;(2)实验小组的同学用稀释后的硫酸溶液测定某黄铜(铜锌合金)中铜的质量分数,他们取了10g黄铜粉末,向其中逐滴加入稀硫酸,生成氢气质量与所加稀硫酸质量之间的变化关系如图所示,求:
①m的数值为0.12g
②黄铜中铜的质量分数(要有解答过程).
分析 (1)根据溶液稀释前后溶质的质量不变,结合题意进行分析解答.
(2)锌与稀硫酸反应生成硫酸锌和氢气,铜不与稀硫酸反应,由生成氢气质量与所加稀硫酸质量之间的变化关系图,前恰好完全反应时,消耗稀硫酸的质量为30g,由反应的化学方程式,列式计算出生成氢气的质量、参加反应的锌的质量,进而计算出黄铜中铜的质量分数.
解答 解:(1)设需要这种浓硫酸体积x,根据溶液稀释前后溶质的质量不变,
则184g×19.6%=1.84g/cm3×x×98% x=20cm3=20mL.
(2)设生成氢气的质量为x,参加反应的锌的质量为y,
Zn+H2SO4═ZnSO4+H2↑
65 98 2
y 30g×19.6% x
①$\frac{98}{2}=\frac{30g×19.6%}{x}$ x=0.12g
②$\frac{65}{98}=\frac{y}{30g×19.6%}$ y=3.9g
黄铜中铜的质量分数为$\frac{10g-3.9g}{10g}$×100%=61%.
答:(1)需要这种浓硫酸20mL;(2)①0.12;②黄铜中铜的质量分数为61%.
点评 本题难度不大,掌握根据化学方程式的计算、溶液稀释前后溶质的质量不变即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
3. 在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )
在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )
 在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )
在一定质量的甲溶液中逐滴加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系能用如图所示的曲线表示的是( )| 序号 | 甲 | 乙 |
| A | HCl溶液 | Zn粒 |
| B | 石灰水 | 二氧化碳 |
| C | H2SO4溶液 | NaOH溶液 |
| D | AgNO3溶液 | Cu粉 |
| A. | A | B. | B | C. | C | D. | D |
7. 研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】过氧化氢生成氧气的快慢与催化剂种类有关
【实验方案】常温下,在两瓶相同体积、浓度相同的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间.
【进行实验】:图示是他们进行实验的装置图.气体发生装置中A仪器的名称是:锥形瓶,此实验中B处宜采用的气体收集方法是排水法.
【结论】该探究过程得出的结论相同条件下,H2O2生成O2的快慢与催化剂的种类有关.
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否变.
 研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“过氧化氢生成氧气的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:【假设】过氧化氢生成氧气的快慢与催化剂种类有关
【实验方案】常温下,在两瓶相同体积、浓度相同的过氧化氢溶液中分别加入相同质量的二氧化锰和红砖粉,测量各生成一瓶(相同体积)氧气所需要的时间.
【进行实验】:图示是他们进行实验的装置图.气体发生装置中A仪器的名称是:锥形瓶,此实验中B处宜采用的气体收集方法是排水法.
| 试验编号 | 1 | 2 |
| 反应物 | 6%的过氧化氢 | 6%的过氧化氢 |
| 催化剂 | 1g红砖粉 | 1g二氧化锰 |
| 时间 | 152s | 35s |
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰和红砖粉是否是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的质量和化学性质是否变.
1.有一包白色粉末,由NH4Cl、Na2CO3、NaCl、CaCO3中的两种组成,为确定其成分,小刚同学进行了如下探究:
(1)收集到以下可能用到的相关资料
[资料1]部分物质的溶解性表
[资料2]铵盐能与碱反应,放出氨气.
(2)探究一:取样品溶于足量的水中,样品全部溶解,则白色粉末中一定无CaCO3.
(3)探究二:[提出猜想]得到的溶液中可能含有的溶质是:
猜想1:Na2CO3和NaCl
猜想2:NH4Cl和NaCl
猜想3:NH4Cl和Na2CO3
[实验验证](将下表中的①②③处填写完整)
[实验反思]某同学认真研究了探究过程,认为“探究二”只需要使用一种试剂,一步就能得出结论.你认为这种试剂可能是Ca(OH)2(填化学式).
(1)收集到以下可能用到的相关资料
[资料1]部分物质的溶解性表
| 阴离子 | OH- | Cl- | CO32- |
| 阳离子 | |||
| Ca2+ | 微 | 溶 | 不 |
| NH4+ | 溶、挥 | 溶 | 溶 |
(2)探究一:取样品溶于足量的水中,样品全部溶解,则白色粉末中一定无CaCO3.
(3)探究二:[提出猜想]得到的溶液中可能含有的溶质是:
猜想1:Na2CO3和NaCl
猜想2:NH4Cl和NaCl
猜想3:NH4Cl和Na2CO3
[实验验证](将下表中的①②③处填写完整)
| 步骤 | 实验操作 | 实验现象 | 相应的结论 |
| 一 | 取样,加入稀盐酸 | ①有气泡产生 | 猜想2不成立 |
| 二 | ②加入氢氧化钠溶液 | 有刺激性气味气体生成 | 猜想③,成立 |
 化学课上我们曾经观察过如图所示的实验.
化学课上我们曾经观察过如图所示的实验. 溶解是生活中常见的现象.
溶解是生活中常见的现象.