题目内容
17. 溶解是生活中常见的现象.
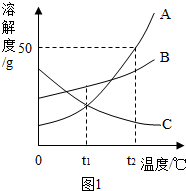
溶解是生活中常见的现象.(1)A、B、C三种物质的溶解度曲线如图1所示.
①t1℃时,A、C两种物质的饱和溶液中溶质质量分数相等;
②t2℃时,把60gA放入100g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3(最简比);
③将t2℃的A、B、C三种物质的饱和溶液都降温至t1℃,所得三种溶液的溶质质量分数的由大到小关系是B>A>C;
④将C的饱和溶液变为不饱和溶液,可采用降温方法(写出一种即可).
(2)图2是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程.
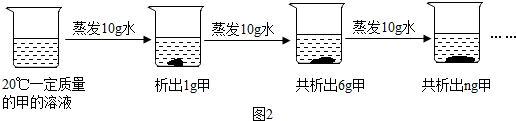
①蒸发前原溶液是不饱和(填“饱和”或“不饱和”)溶液;
②n的数值是11g;
③依据上述实验,你认为甲的溶解度随温度变化的趋势是C(填字母).
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)①通过分析溶解度曲线可知,t1℃时,A、C两种物质的溶解度相等,所以饱和溶液中溶质质量分数相等;
②t2℃时,A物质的溶解度是50g,所以把60gA放入100g水中能得到A的饱和溶液,其中溶质和溶液的质量比为:150g:50g=3:1;
③A、B物质的溶解度随温度的升高而增大,C物质的溶解度随温度的降低而增大,C物质降温不会析出晶体,在t1℃时B物质的溶解度最大,所以在t2℃时,A、B、C三种饱和溶液降温至t1℃时溶质的质量分数由大到小的顺序是B>A>C;
④C物质的溶解度随温度的升高而减小,所以将C的饱和溶液变为不饱和溶液,可采用降温方法;
(2)①蒸发前的烧杯底部没有固体,第一次蒸发10g水,析出1g晶体,第二次蒸发10g水析出5g晶体,所以蒸发前原溶液是不饱和溶液;
②蒸发前的烧杯底部没有固体,第一次蒸发10g水,析出1g晶体,第二次蒸发10g水析出5g晶体,所以蒸发前原溶液是不饱和溶液,第三次蒸发10g水析5g晶体,所以共析出11g;
③题中析出晶体是通过蒸发溶剂得到的,不能判断出温度对溶解度的影响,故选:C.
故答案为:(1)①t1;
②1:3;
③B>A>C;
④降温(或加水);
(2)①不饱和;
②11;
③C.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
8.央视二套《这是真的吗》栏目播出了电脑浸在液体中也能正常工作的新鲜事,原来这种无色的液体是被称为“绝缘液”的液态一氟二氯乙烷.这种液体可为手机、电脑“洗澡”,用来清洗电子产品.一氟二氯乙烷的化学式为CCl2FCH3.下列对一氟二氯乙烷的认识,正确的是( )
| A. | 一氟二氯乙烷是无机物 | |
| B. | 一氟二氯乙烷的相对分子量为117克 | |
| C. | 一氟二氯乙烷由5种元素组成 | |
| D. | 一氟二氯乙烷中碳元素与氢元素的质量比为8:1 |
2.某同学发现,上个月做实验用的氢氧化钠溶液忘记了盖瓶盖.对于该溶液的探究,同学们的实验设计合理的是( )
| A. | 取样,在溶液中加入少量的稀盐酸,如果无气泡产生,则可证明该溶液没有变质 | |
| B. | 取样,在溶液中滴加酚酞,如酚酞呈无色,则溶液已完全变质 | |
| C. | 取样,在溶液中加入过量滴有酚酞的氯化钡溶液,如产生白色沉淀,且上层清液呈红色,则溶液未完全变质 | |
| D. | 取样,在溶液中加入过量稀盐酸,则可除去氢氧化钠溶液中产生的杂质 |
9.分子与原子的本质区别是( )
| A. | 原子比分子小 | |
| B. | 在化学反应中分子可以分成原子,而原子不能再分 | |
| C. | 分子是不断运动的,原子是静止的 | |
| D. | 分子能直接构成物质,原子不能直接构成物质 |

 (1)实验室现有质量分数为98%(密度:1.84g/cm3)的浓硫酸,欲将这种浓硫酸稀释为19.6%的稀硫酸184g,要这种浓硫酸体积为mL;
(1)实验室现有质量分数为98%(密度:1.84g/cm3)的浓硫酸,欲将这种浓硫酸稀释为19.6%的稀硫酸184g,要这种浓硫酸体积为mL;
