题目内容
6.某烟气脱硫的工艺不仅能消除SO2,还能将其转化为石膏(CaSO4•2H2O)等产品,实现“变废为宝”.主要物质转化关系如下: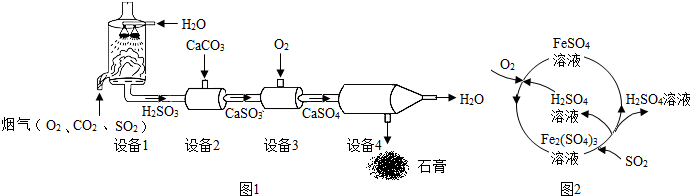
(1)设备1中,通过喷淋水脱去烟气中的SO2,该反应的化学方程式为SO2+H2O=H2SO3,若将烟气中的SO2直接排放到空气中,可能会导致的污染问题是酸雨.
(2)设备2中,加入CaCO3的目的是将H2SO3转化为CaSO3.
(3)设备3中反应的化学方程式是2CaSO3+O2=2CaSO4,反应中化合价升高的元素是S.
(4)另一工厂为防治SO2的污染,另外设计了一种治污方法,不仅吸收了二氧化硫,同时也得到了硫酸等工业产品,该工艺流程如图所示.
①Fe2(SO4)3吸收SO2的化学方程式是:Fe2(SO4)3+2H2O+SO2═2FeSO4+2H2SO4.
②该流程中可循环利用的物质是H2SO4和FeSO4.
分析 (1)根据二氧化硫和水反应生成亚硫酸,将烟气中的SO2直接排放到空气中,可能会导致酸雨进行分析;
(2)根据碳酸钙和亚硫酸反应会生成亚硫酸钙、水和二氧化碳进行分析;
(3)根据亚硫酸钙和氧气反应生成硫酸钙,反应前后各元素的化合价进行分析;
(4)根据质量守恒的和流程中各物质参与的反应进行分析.
解答 解:(1)二氧化硫和水反应生成亚硫酸,化学方程式为:SO2+H2O=H2SO3,将烟气中的SO2直接排放到空气中,可能会导致酸雨;
(2)碳酸钙和亚硫酸反应会生成亚硫酸钙、水和二氧化碳,所以设备2中,加入CaCO3的目的是将H2SO3转化为CaSO3;
(3)亚硫酸钙和氧气反应生成硫酸钙,化学方程式为:2CaSO3+O2=2CaSO4,反应中化合价升高的元素是S;
(4)①生成物质中2个铁原子,4个硫原子,16个氢原子,8个氧原子,反应物中2个铁原子,4个硫原子,14个氧原子,所以空格处是H2O;
②通过分析反应流程可知,硫酸、硫酸亚铁既是反应物,也是生成物,所以该流程中可循环利用的物质是H2SO4和FeSO4.
故答案为:(1)SO2+H2O=H2SO3,形成酸雨;
(2)CaSO3;
(3)2CaSO3+O2=2CaSO4,S;
(4)①H2O,②H2SO4和FeSO4.
点评 本题考查了燃料脱硫的原理等,题中难度中等,注意化学方程式的书写,为该题的易错点和难点.注意流程分析和设计方法和理解是解答的关键.

练习册系列答案
相关题目
16.实验室里制取并收集二氧化碳气体时一般有以下操作步骤:①检查装置的气密性 ②连接装置 ③加入大理石 ④加入稀盐酸 ⑤收集 ⑥验满.其中排列顺序正确的是( )
| A. | ①②③④⑤⑥ | B. | ②①④③⑤⑥ | C. | ②①③④⑤⑥ | D. | ②③④①⑤⑥ |
17.下列说法中正确的是( )
| A. | 甲状腺肿大可能是缺铁所致 | |
| B. | 霉变的花生米洗净后仍可正常食用 | |
| C. | 可用结晶的方法提纯混有少量氯化钠的硝酸钾 | |
| D. | 铅、金、钛属于金属元素,硫、氮、汞属于非金属元素 |
14.对化学概念的准确理解是正确运用的前提,下列有关认识不正确的是( )
| A. | 氧化反应一定是化合反应 | |
| B. | 复分解反应中各元素的化合价一定不变 | |
| C. | 置换反应一定有单质生成 | |
| D. | 有盐和水生成的反应不一定是中和反应 |
11.某无色溶液中滴入酚酞溶液,溶液仍然呈无色.下列关于该无色溶液的说法正确的是( )
| A. | 一定是烧碱溶液 | B. | 一定是酸溶液 | C. | 可能是中性溶液 | D. | 一定是盐溶液 |
18.将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(Na)$\stackrel{{O}_{2}}{→}$钠的氧化物$\stackrel{{H}_{2}O}{→}$氢氧化钠溶液$\stackrel{C{O}_{2}}{→}$白色固体
【提出问题】常温下钠与氧气反应,产物有哪些?
【查阅资料】钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
【作出猜想】常温下钠与氧气反应的产物.
猜想1:Na2O,
猜想2:Na2O2,
猜想3:①Na2O和Na2O2
【实验探究一】
【继续探究】钠在空气中放置一段时间得到白色固体的成分
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验探究二】
【实验反思】
(1)类比氧化铁与盐酸的反应,写出氧化钠与盐酸反应的化学方程式 ⑥Na2O+2HCl=2NaCl+H2O.
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为⑦O2.
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2 ⑧不是碱性氧化物(填“是”或“不是”).
钠(Na)$\stackrel{{O}_{2}}{→}$钠的氧化物$\stackrel{{H}_{2}O}{→}$氢氧化钠溶液$\stackrel{C{O}_{2}}{→}$白色固体
【提出问题】常温下钠与氧气反应,产物有哪些?
【查阅资料】钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
【作出猜想】常温下钠与氧气反应的产物.
猜想1:Na2O,
猜想2:Na2O2,
猜想3:①Na2O和Na2O2
【实验探究一】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | ②没有气泡生成 | 猜想1正确 |
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验探究二】
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量③氯化钡溶液(或氯化钙溶液). | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.过滤、取少量滤液加入 ④无色酚酞试液 | ⑤试液变红 |
(1)类比氧化铁与盐酸的反应,写出氧化钠与盐酸反应的化学方程式 ⑥Na2O+2HCl=2NaCl+H2O.
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为⑦O2.
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2 ⑧不是碱性氧化物(填“是”或“不是”).

