题目内容
17.下列说法中正确的是( )| A. | 甲状腺肿大可能是缺铁所致 | |
| B. | 霉变的花生米洗净后仍可正常食用 | |
| C. | 可用结晶的方法提纯混有少量氯化钠的硝酸钾 | |
| D. | 铅、金、钛属于金属元素,硫、氮、汞属于非金属元素 |
分析 A、根据碘的生理功能分析判断.
B、根据霉变的花生米含有黄曲霉毒素分析判断.
C、根据固体物质从溶液中结晶析出的方法分析判断.
D、根据物质的分类进行分析断.
解答 解:A、碘是合成甲状腺激素的主要成分,缺乏会患甲状腺肿大,故A错误.
B、食物在霉变的过程中会生成一种有毒的物质-黄曲霉毒素,即使洗净后也不能食用,故B错误.
C、如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂,硝酸钾中混有少量氯化钠,提纯的是硝酸钾,硝酸钾的溶解度随温度变化较大,可用冷却热饱和溶液的方法,故C正确.
D、汞属于金属元,故D错误.
故选C.
点评 化学来源于生产、生活,也服务于生产、生活,与生产、生活相关的化学知识,关乎我们的生存、健康和社会的发展,是中考热点之一.

练习册系列答案
相关题目
7.溶液是生产生活中常见的物质,依据相关信息回答问题:
资料:硝酸钾的溶解度数据(部分数据已做整数处理)如表所示:
(1)硝酸钾是一种常用的复合肥,能为作物补充N和K(填元素符号).
(2)A、B、C、D四个烧杯中分别盛有100g水,在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示.

①D(填字母序号)中盛的是不饱和溶液.
②烧杯A、B、C中溶液的溶质质量分数大小关系为A=B=C.
(3)若将(2)中烧杯C的液体倒入烧杯A中,通过调节温度,可使得混合后溶液恰好饱和且不存在KNO3固体.则混合液的温度应该调整至接近50℃.
资料:硝酸钾的溶解度数据(部分数据已做整数处理)如表所示:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 溶解度/g | 21 | 32 | 46 | 64 | 86 | 110 | 138 |
(2)A、B、C、D四个烧杯中分别盛有100g水,在40℃时,向四个烧杯中分别加入110g、86g、64g、32g硝酸钾,充分溶解,如图所示.

①D(填字母序号)中盛的是不饱和溶液.
②烧杯A、B、C中溶液的溶质质量分数大小关系为A=B=C.
(3)若将(2)中烧杯C的液体倒入烧杯A中,通过调节温度,可使得混合后溶液恰好饱和且不存在KNO3固体.则混合液的温度应该调整至接近50℃.
8.下列实验操作正确的是( )
| A. |  量取液体 | B. |  问气体气味 | C. |  甲烷验纯 | D. |  稀释浓硫酸 |
5.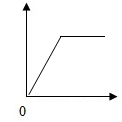 下列各选项与右图所示曲线相符的是( )
下列各选项与右图所示曲线相符的是( )
 下列各选项与右图所示曲线相符的是( )
下列各选项与右图所示曲线相符的是( )| 选项 | 横坐标 | 纵坐标 |
| A | 向一定量稀硫酸中加入锌粉的质量 | 溶液中氢元素的质量 |
| B | 向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量 | 产生气体的质量 |
| C | 向一定量的澄清石灰水中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
| D | 在一定温度下,向一定量的不饱和硝酸钾溶液中加入硝酸钾固体的质量 | 溶液中溶质的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
2.芯片是电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的.硅及其氧化物能发生如下反应:
①Si+O2$\frac{\underline{\;\;△\;\;}}{\;}$SiO2 ②SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
③SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ ④Si+2NaOH+H2O═Na2SiO3+2H2↑
下列说法不正确的是( )
①Si+O2$\frac{\underline{\;\;△\;\;}}{\;}$SiO2 ②SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
③SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ ④Si+2NaOH+H2O═Na2SiO3+2H2↑
下列说法不正确的是( )
| A. | ③属于置换反应 | |
| B. | 上述反应中生成了三种可燃性气体 | |
| C. | 硅不属于金属材料 | |
| D. | Si和SiO2在一定条件下可以相互转化 |
9.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见表.下列说法中不正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前物质质量/g | 8 | 32 | 5 | 4 |
| 反应后物质质量/g | 16 | 4 | x | 24 |
| A. | 该反应为分解反应 | |
| B. | 乙、丁两种物质间反应的质量比为7:5 | |
| C. | 甲、乙两种物质间参加反应的质量比为1:4 | |
| D. | 丙可能为该反应的催化剂 |
7.“H68黄铜”(即铜含昼为68%的铜锌合金),可焊性、耐蚀性能等均佳,是应用最广的一种黄铜.小东为测定市场上某黄铜制品中铜的实际含量,将10g黄铜样品加入烧杯中,分六次加人某稀硫酸,每次充分反应后,测得剩余固体的质量,数据记录如下:
(1)小东要配制50g溶质的质量分数为19.6%的稀硫酸用于测得黄铜样品,计算他所需98%的浓硫酸的质量和加入水的质量.(写出计算过程)
(2)分析上表数据,小东测得的黄铜样品的实际含铜质量分数为67.5%.
(3)实验结束后,小东测得剩余溶液显酸性.计算剩余溶液中硫酸的质量分数.(精确到0.1%)
| 实验记录序号 | (1) | (2) | (3) | (4) | (5) | (6) |
| 加入稀硫酸质量/g | 5 | 5 | 5 | 5 | 5 | 5 |
| 剩余固体质量/g | 9.35 | 8.70 | 8.05 | 7.40 | 6.75 | 6.75 |
(2)分析上表数据,小东测得的黄铜样品的实际含铜质量分数为67.5%.
(3)实验结束后,小东测得剩余溶液显酸性.计算剩余溶液中硫酸的质量分数.(精确到0.1%)