题目内容
14.对化学概念的准确理解是正确运用的前提,下列有关认识不正确的是( )| A. | 氧化反应一定是化合反应 | |
| B. | 复分解反应中各元素的化合价一定不变 | |
| C. | 置换反应一定有单质生成 | |
| D. | 有盐和水生成的反应不一定是中和反应 |
分析 A、根据氧化反应是指物质与氧发生的反应,化合反应即“多变一”,进行判断;
B、根据复分解反应是指两种化合物相互交换成分生成另外的两种化合物的反应进行解答;
C、根据置换反应是一种单质和化合物反应生成另外的单质和化合物的反应进行解答;
D、根据中和反应是指酸和碱反应生成盐和水的反应进行解答.
解答 解:A、根据氧化反应是指物质与氧发生的反应,化合反应即“多变一”,如 蜡烛+氧气→点燃二氧化碳+水,是氧化反应,但不是化合反应,故A错误;
B、复分解反应是指两种化合物相互交换成分生成另外的两种化合物的反应,所以复分解反应中各元素的化合价一定不变,故B正确;
C、置换反应是一种单质和化合物反应生成另外的单质和化合物的反应,所以置换反应一定有单质生成,故C正确;
D、中和反应是指酸和碱反应生成盐和水的反应,但是有盐和水生成的反应不一定是中和反应,例如氧化铁和盐酸生成氯化铁和水,不属于中和反应,故D正确.
故选:A.
点评 解答本题要掌握各种概念等方面的知识,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
相关题目
4. 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
查阅资料:Ⅰ.电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对以下实验的影响.
探究活动:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定:甲组同学称取一定质量的待测液于烧杯中,加水稀释,
用带有刻度的滴管逐滴加入溶质质量分数为9.8%的稀硫酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
(1)写出氢氧化钠与稀硫酸反应的化学方程式:2NaOH+H2SO4═Na2SO4+2H2O.
(2)为了准确计算所称取待测液中氢氧化钠的质量,则应该选用上述表格中的稀硫酸的体积为10.0mL,还需要补充的数据是稀硫酸的密度.
【实验2】沉淀法测定:乙组同学按下图所示的实验步骤进行实验:
资料摘要:氢氧化钠与氯化镁溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl

(3)学习小组的同学欲检验②中加入的氯化镁溶液已过量,进行以下的操作:
A同学:将原试液静置后,直接向上层清夜中滴加氢氧化钠溶液.
B同学:将原试液静置后,取上层清液于试管中,滴加氢氧化钠溶液.
其中合理的是B(填“A”或“B”),理由是A中原试液容器底部有氢氧化镁沉淀.
(4)步骤④中洗涤沉淀物的洗涤液中含有的溶质为氯化钠.
 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.查阅资料:Ⅰ.电解饱和食盐水的化学方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
Ⅱ.忽略其他可能发生的反应对以下实验的影响.
探究活动:测定待测液中氢氧化钠的质量分数
【实验1】用酸碱中和法测定:甲组同学称取一定质量的待测液于烧杯中,加水稀释,
用带有刻度的滴管逐滴加入溶质质量分数为9.8%的稀硫酸,边加边振荡,用pH计测定溶液的pH,所得数据如下:
| 加入稀硫酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
(2)为了准确计算所称取待测液中氢氧化钠的质量,则应该选用上述表格中的稀硫酸的体积为10.0mL,还需要补充的数据是稀硫酸的密度.
【实验2】沉淀法测定:乙组同学按下图所示的实验步骤进行实验:
资料摘要:氢氧化钠与氯化镁溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl

(3)学习小组的同学欲检验②中加入的氯化镁溶液已过量,进行以下的操作:
A同学:将原试液静置后,直接向上层清夜中滴加氢氧化钠溶液.
B同学:将原试液静置后,取上层清液于试管中,滴加氢氧化钠溶液.
其中合理的是B(填“A”或“B”),理由是A中原试液容器底部有氢氧化镁沉淀.
(4)步骤④中洗涤沉淀物的洗涤液中含有的溶质为氯化钠.
5.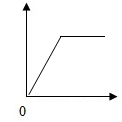 下列各选项与右图所示曲线相符的是( )
下列各选项与右图所示曲线相符的是( )
 下列各选项与右图所示曲线相符的是( )
下列各选项与右图所示曲线相符的是( )| 选项 | 横坐标 | 纵坐标 |
| A | 向一定量稀硫酸中加入锌粉的质量 | 溶液中氢元素的质量 |
| B | 向一定量的氢氧化钠和碳酸钠混合溶液中加入稀盐酸的质量 | 产生气体的质量 |
| C | 向一定量的澄清石灰水中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
| D | 在一定温度下,向一定量的不饱和硝酸钾溶液中加入硝酸钾固体的质量 | 溶液中溶质的质量分数 |
| A. | A | B. | B | C. | C | D. | D |
2.芯片是电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的.硅及其氧化物能发生如下反应:
①Si+O2$\frac{\underline{\;\;△\;\;}}{\;}$SiO2 ②SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
③SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ ④Si+2NaOH+H2O═Na2SiO3+2H2↑
下列说法不正确的是( )
①Si+O2$\frac{\underline{\;\;△\;\;}}{\;}$SiO2 ②SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
③SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑ ④Si+2NaOH+H2O═Na2SiO3+2H2↑
下列说法不正确的是( )
| A. | ③属于置换反应 | |
| B. | 上述反应中生成了三种可燃性气体 | |
| C. | 硅不属于金属材料 | |
| D. | Si和SiO2在一定条件下可以相互转化 |
9.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见表.下列说法中不正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前物质质量/g | 8 | 32 | 5 | 4 |
| 反应后物质质量/g | 16 | 4 | x | 24 |
| A. | 该反应为分解反应 | |
| B. | 乙、丁两种物质间反应的质量比为7:5 | |
| C. | 甲、乙两种物质间参加反应的质量比为1:4 | |
| D. | 丙可能为该反应的催化剂 |
19. 实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
 实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )
实验小组探究盐酸和氢氧化钠反应过程中溶液 pH 的变化规律,得到如图所示曲线.下列 有关该实验事实的说法正确的是( )| A. | 该实验是将氢氧化钠溶液滴入盐酸中 | |
| B. | B 点表示盐酸和氢氧化钠恰好完全反应 | |
| C. | C 点时的溶液能使酚酞试液变红 | |
| D. | A 点时,溶液中的溶质有氯化钠和氢氧化钠 |
 小明同学绘制了如图所示A、B两种固体物质的溶解度曲线:
小明同学绘制了如图所示A、B两种固体物质的溶解度曲线: