题目内容
5.根据如图的实验过程和提供的数据,可知样品中碳的质量分数为多少?写出计算过程.
分析 铁能和稀硫酸反应生成硫酸亚铁和氢气,根据反应的化学方程式和混合物数据可以进行相关方面的计算.
解答 解:设铁的质量为x,
Fe+H2SO4═FeSO4+H2↑,溶液质量增加
56 2 56-2=54
x 55.4g-50g=5.4g
$\frac{56}{x}$=$\frac{54}{5.4g}$,
x=5.6g,
样品中碳的质量分数为:$\frac{10g-5.6g}{10g}$×100%=44%,
答:样品中碳的质量分数为44%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
相关题目
7.“H68黄铜”(即铜含昼为68%的铜锌合金),可焊性、耐蚀性能等均佳,是应用最广的一种黄铜.小东为测定市场上某黄铜制品中铜的实际含量,将10g黄铜样品加入烧杯中,分六次加人某稀硫酸,每次充分反应后,测得剩余固体的质量,数据记录如下:
(1)小东要配制50g溶质的质量分数为19.6%的稀硫酸用于测得黄铜样品,计算他所需98%的浓硫酸的质量和加入水的质量.(写出计算过程)
(2)分析上表数据,小东测得的黄铜样品的实际含铜质量分数为67.5%.
(3)实验结束后,小东测得剩余溶液显酸性.计算剩余溶液中硫酸的质量分数.(精确到0.1%)
| 实验记录序号 | (1) | (2) | (3) | (4) | (5) | (6) |
| 加入稀硫酸质量/g | 5 | 5 | 5 | 5 | 5 | 5 |
| 剩余固体质量/g | 9.35 | 8.70 | 8.05 | 7.40 | 6.75 | 6.75 |
(2)分析上表数据,小东测得的黄铜样品的实际含铜质量分数为67.5%.
(3)实验结束后,小东测得剩余溶液显酸性.计算剩余溶液中硫酸的质量分数.(精确到0.1%)
20.如表有关物质的鉴别、检验、除杂所用的试剂或方法正确的是( )
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 鉴别氯化钠溶液和稀盐酸 | 无色酚酞 |
| B | 鉴别硫酸钠溶液和硝酸钾溶液 | 氯化钡溶液 |
| C | 除去氧化钙中少量的碳酸钙 | 加水溶解后过滤 |
| D | 除去CO2中的HCl | 碳酸氢钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
15.如图所示的实验操作不正确的是( )
| A. |  铁丝在氧气中燃烧 | B. |  读取液体的体积 | ||
| C. |  除去CO中的CO2 | D. |  蒸发结晶 |
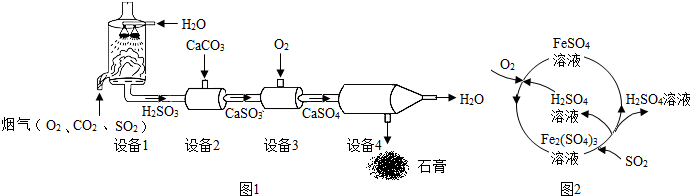

 现有A、B、C、D、E、F、G七种物质,B是气体单质,C、F是常见的金属,其中F为红色,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图所示关系:
现有A、B、C、D、E、F、G七种物质,B是气体单质,C、F是常见的金属,其中F为红色,D为浅绿色溶液,G为蓝色溶液,它们之间存在如图所示关系: