题目内容
19.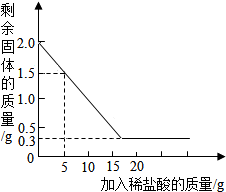 某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5克 | 1.5克 |
| 第二次加入5克 | 1.0克 |
| 第三次加入5克 | 0.5克 |
| 第四次加入5克 | 0.3克 |
(2)该石灰石样品中碳酸钙的质量是1.7克.
(3)所用稀盐酸中溶质的质量分数是多少?
分析 由表中数据可知,第二次反应的碳酸钙质量是0.5g,前三次中的稀盐酸完全反应,因此根据前三次中任一次的数据可以计算所用稀盐酸中溶质的质量分数.
解答 解:(1)分析上述图与表,第二次加入稀盐酸后,剩余固体的质量是1.0g.
故填:1.0.
(2)该石灰石样品中碳酸钙的质量为:2g-0.3g=1.7g,
故填:1.7.
(3)解:设HCl的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑,
100 73
0.5g x
$\frac{100}{0.5g}$=$\frac{73}{x}$,
x=0.365g,
所用稀盐酸中溶质的质量分数为:$\frac{0.365g}{5g}$×100%=7.3%,
答:稀盐酸的质量分数为7.3%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,同时考查了分析表中数据的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
9.2012年第30届奥运会将在英国伦敦举行.兴奋剂检测是对运动员的一项重要检测,诺龙是兴奋剂中的一种,其化学式为C18H26O2.下列关于诺龙的说法正确的是( )
| A. | 诺龙中含有氧分子 | |
| B. | 诺龙中碳、氢、氧三种元素的质量比为9:13:1 | |
| C. | 一个诺龙分子中含有46个原子 | |
| D. | 诺龙里氢元素的质量分数最高 |
7.在食盐中加入碘酸钾( KIO3)有益于防治地方性甲状腺肿大下表是某市场销售的一种“加碘食盐”包装袋上的部分说明.
(1)上述“含碘量”中的碘是指B(填代号)
A.碘酸钾 B.碘元素 C.碘单质 D.碘分子
(2)碘酸钾( KIO3)中碘的化合价为+5.
(3)由上述文字说明可推测碘酸钾的化学性质是(答一条即可)受热易分解.
(4)碘酸钾中碘的质量分数为59.3%,上述“加碘食盐”1000g中含碘酸钾的最低质量为11.9mg(保留一位小数).
(5)用固体单质碘(I2)与氯酸钾在一定条件下发生反应,可制得固体碘酸钾(KIO3),同时生成气体氯单质(Cl2).该反应的化学方程式为2KClO3+I2=2KIO3+Cl2↑.
| 配料 | 含碘量 | 保质期 | 食用方法 | 贮藏指南 |
| 氯化钠、碘酸钾 | 20-40mg∕kg | 18个月 | 勿长时间炖炒 | 避热、避光、密封 |
A.碘酸钾 B.碘元素 C.碘单质 D.碘分子
(2)碘酸钾( KIO3)中碘的化合价为+5.
(3)由上述文字说明可推测碘酸钾的化学性质是(答一条即可)受热易分解.
(4)碘酸钾中碘的质量分数为59.3%,上述“加碘食盐”1000g中含碘酸钾的最低质量为11.9mg(保留一位小数).
(5)用固体单质碘(I2)与氯酸钾在一定条件下发生反应,可制得固体碘酸钾(KIO3),同时生成气体氯单质(Cl2).该反应的化学方程式为2KClO3+I2=2KIO3+Cl2↑.
4.2010年6月5曰世界环境口的中国主题是“低碳减排、绿色生活”,下列做法与此不符合的是( )
| A. | 提倡垃圾分类,物有所用 | B. | 少用空调,温控适度 | ||
| C. | 广泛使用一次性塑料袋 | D. | 研发太阳能、风能、核能等新能源 |
9.化学兴趣小组的同学在实验室发现了一个保管不当,盛有无色溶液的试剂瓶,且标签破损(如图),其残缺的标签中只剩下“Na”字样.老师告诉他们,这瓶溶液中的溶质可能是氢氧化钠、氯化钠或碳酸钠.同学们很感兴趣,决定对其成分进行探究.
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是A(填字母代号).
A.酸 B.碱 C.盐
【查阅资料】碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应.
【作出猜想】
(1)可能是NaOH溶液;
(2)可能是Na2CO3溶液;
(3)可能是NaCl溶液.
【设计并实验】
由此,同学们得出结论:该溶液是碳酸钠溶液.
老师指出该结论不严密.理由是:氢氧化钠溶液在空气中敞口放置,发生变质,能产生与实验1和2相同的现象.请写出氢氧化钠溶液在空气中变质的化学方程式2NaOH+CO2=Na2CO3+H2O.老师提示,不需另取样,只要在实验1后的试管中加入足量CaCl2溶液,若观察到产生白色沉淀,且溶液红色不褪去现象,即可说明该溶液中有氢氧化钠.
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是A(填字母代号).
A.酸 B.碱 C.盐
【查阅资料】碱性的Na2CO3溶液与中性的CaCl2溶液能发生复分解反应.
【作出猜想】
(1)可能是NaOH溶液;
(2)可能是Na2CO3溶液;
(3)可能是NaCl溶液.
【设计并实验】
| 实验 | 实验操作 | 主要实验现象 | 实验结论和解释 |
1 | 取样于试管,向其中滴加几滴无色酚酞溶液 | 无色溶液变红色 | 该溶液不可能是氯化钠溶液,理由是氯化钠溶液呈中性,不能使酚酞变色 |
2 | 取样于另一支试管中,向其中滴加足量的稀盐酸 | 产生大量的气泡 | 该溶液中溶质为碳酸钠,有关反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑ |
老师指出该结论不严密.理由是:氢氧化钠溶液在空气中敞口放置,发生变质,能产生与实验1和2相同的现象.请写出氢氧化钠溶液在空气中变质的化学方程式2NaOH+CO2=Na2CO3+H2O.老师提示,不需另取样,只要在实验1后的试管中加入足量CaCl2溶液,若观察到产生白色沉淀,且溶液红色不褪去现象,即可说明该溶液中有氢氧化钠.