题目内容
7.在食盐中加入碘酸钾( KIO3)有益于防治地方性甲状腺肿大下表是某市场销售的一种“加碘食盐”包装袋上的部分说明.| 配料 | 含碘量 | 保质期 | 食用方法 | 贮藏指南 |
| 氯化钠、碘酸钾 | 20-40mg∕kg | 18个月 | 勿长时间炖炒 | 避热、避光、密封 |
A.碘酸钾 B.碘元素 C.碘单质 D.碘分子
(2)碘酸钾( KIO3)中碘的化合价为+5.
(3)由上述文字说明可推测碘酸钾的化学性质是(答一条即可)受热易分解.
(4)碘酸钾中碘的质量分数为59.3%,上述“加碘食盐”1000g中含碘酸钾的最低质量为11.9mg(保留一位小数).
(5)用固体单质碘(I2)与氯酸钾在一定条件下发生反应,可制得固体碘酸钾(KIO3),同时生成气体氯单质(Cl2).该反应的化学方程式为2KClO3+I2=2KIO3+Cl2↑.
分析 (1)食品、药品、营养品、矿泉水等物质中的“碘”等不是以单质、化合物、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.
(2)根据在化合物中正负化合价代数和为零,结合碘酸钾的化学式进行解答.
(3)根据加碘盐包装袋上的部分说明(勿长时间炖炒,避热、避光、密封),进行分析解答.
(4)根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}$×100%,进行分析解答.
(5)根据“单质碘(I2)与氯酸钾在一定条件下发生反应,可制得碘酸钾(KIO3),同时生成氯单质(Cl2)”写出化学方程式即可.
解答 解:(1)“含碘量”中的碘等不是以单质、化合物、分子、原子等形式存在,这里所指的“碘”是强调存在的元素,与具体形态无关.
(2)钾元素显+1价,氧元素显-2价,设碘元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则x=+5价.
(3)由加碘盐包装袋上的部分说明,勿长时间炖炒,避热、避光、密封,可得碘酸钾的一种化学性质是:受热易分解或受热不稳定.
(4)碘酸钾中碘的质量分数为$\frac{127}{39+127+16×3}$×100%≈59.3%,上述“加碘食盐”1000g中含碘的最低质量1000g×59.3%=593g=0.593kg,则含碘酸钾的质量为:0.593kg×20mg∕kg=11.86mg≈11.9mg,
(5)根据“单质碘(I2)与氯酸钾在一定条件下发生反应,可制得碘酸钾(KIO3),同时生成氯单质(Cl2)”可得出该方程式为:2KClO3+I2=2KIO3+Cl2↑.
故答案为:(1)B;(2)+5;(3)受热易分解(或受热不稳定,合理即可);(4)59.3%,11.9mg
(5)2KClO3+I2=2KIO3+Cl2↑
点评 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算、元素等进行分析问题、解决问题的能力.

| A. | 烧碱属于碱,故纯碱也属于碱 | |
| B. | 氢氧化铝可治疗胃酸过多,故氢氧化钠也可以治疗胃酸过多 | |
| C. | 金属单质能导电,能导电的单质不一定是金属 | |
| D. | 酸的组成中含氢元素,则含氢元素的物质一定是酸 |
 如图是老师放置在实验桌上的三瓶无色气体,其中两瓶可能是O2和CO2.下列关于这三种气体的鉴别方法中,不正确的是( )
如图是老师放置在实验桌上的三瓶无色气体,其中两瓶可能是O2和CO2.下列关于这三种气体的鉴别方法中,不正确的是( )| A. | 根据瓶③倒置,可判断瓶③存放的不可能是O2和CO2 | |
| B. | 用带火星的木条放入①中,若复燃,则存放的是O2 | |
| C. | 用点燃的木条伸入②中,若火焰熄灭,则存放的不是O2 | |
| D. | 向②中加入少量蒸馏水,若变为红色,则存放的是CO2 |
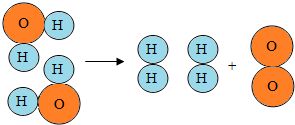 如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )
如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )| A. | 一个水分子由二个氢原子和一个氧原子构成 | |
| B. | 水分解过程中,分子的种类不变 | |
| C. | 水分解后生成氢气和氧气 | |
| D. | 水分解过程中,原子的数目不变 |
| A. | 原子质量 | B. | 原子半径 | C. | 核内中子数 | D. | 核内质子数 |
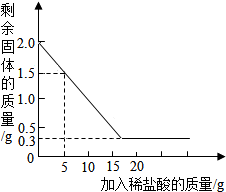 某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5克 | 1.5克 |
| 第二次加入5克 | 1.0克 |
| 第三次加入5克 | 0.5克 |
| 第四次加入5克 | 0.3克 |
(2)该石灰石样品中碳酸钙的质量是1.7克.
(3)所用稀盐酸中溶质的质量分数是多少?
| A. | 高粱酿酒 | B. | 冰雪消融 | ||
| C. | 矿石粉碎 | D. | 分离液态空气制氧气 |
| A. | 用规格为20mL的量筒一次量取16mL溶液,比用规格为10mL的量筒分两次量取16mL溶液的误差大 | |
| B. | 过滤时,为了加速溶液透过滤纸,可以用玻璃棒末端轻轻搅拌滤纸上的混合物 | |
| C. | 受热后的蒸发皿要用坩锅钳夹取,并放在石棉网上冷却 | |
| D. | 配制一定物浓度的溶液,为了避免溶质的损失,直接把称量的固体溶质转移到试剂瓶中 |
