题目内容
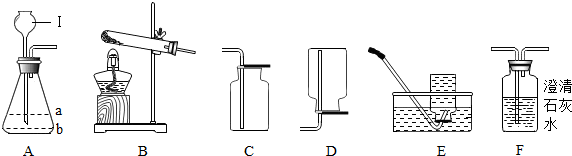
14.实验制取氨气(NH3)是利用氢氧化钙粉末和氯化铵固体加热制取的,已知氨气易溶于水,密度比空气小,则实验制取NH3应选择的装置是( )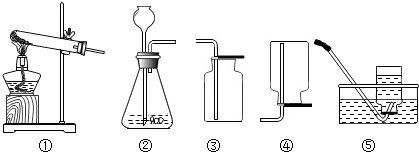
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ②⑤ |
分析 根据实验室制取氨气的反应中药品的状态及反应条件,在发生装置①②选取适合于制取氨气的装置;根据氨气的密度及溶解性,在收集装置③④⑤中选取适合于收集氨气的收集装置.
解答 解:由于实验室用加热氯化铵和氢氧化钙的固体混合物来制取氨气,因此发生装置应选取可用于对固体加热的装置①;由于氨气密度比空气小且极易溶于水的气体,因此在收集氨气时只能选取向下排空气法即装置④收集氨气;即适合制取氨气的装置组合为①④.
故选:A.
点评 根据反应中药品状态及反应条件,确定制取气体时的发生装置;根据所收集气体的密度与溶解性,确定收集该气体可以采用的方法.

练习册系列答案
相关题目
2.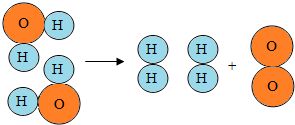 如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )
如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )
 如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )
如图是水分子在一定条件下分解的示意图,从中获得的信息不正确的是( )| A. | 一个水分子由二个氢原子和一个氧原子构成 | |
| B. | 水分解过程中,分子的种类不变 | |
| C. | 水分解后生成氢气和氧气 | |
| D. | 水分解过程中,原子的数目不变 |
19.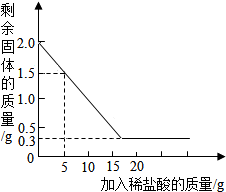 某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
计算:(1)分析上述图与表,第二次加入稀盐酸后,剩余固体的质量是1.0克.
(2)该石灰石样品中碳酸钙的质量是1.7克.
(3)所用稀盐酸中溶质的质量分数是多少?
 某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)
某石灰厂有一批石灰石原料,其中杂质为二氧化硅(二氧化硅不溶于水,不与盐酸反应,高温时不发生分解反应).为了测定该石灰石的纯度,兴趣小组同学取用2克这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸20克分4次加入,充分反应后,经过滤、干燥等操作后称量,每次盐酸用量及剩余固体的质量见表,利用实验数据绘制的图象见图.(化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑)| 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5克 | 1.5克 |
| 第二次加入5克 | 1.0克 |
| 第三次加入5克 | 0.5克 |
| 第四次加入5克 | 0.3克 |
(2)该石灰石样品中碳酸钙的质量是1.7克.
(3)所用稀盐酸中溶质的质量分数是多少?
6.下列关于二氧化碳的叙述中,错误的是( )
| A. | 自然界中二氧化碳处于循环状态 | |
| B. | 二氧化碳气体能使紫色石蕊试液变红 | |
| C. | 干冰可用于储藏食物和人工降雨 | |
| D. | 可用氢氧化钠溶液检验二氧化碳 |
4.某校研究小组的同学通过实验探究了CuO对氯酸钾分解的催化作用,并与MnO2相比较,研究其催化能力.部分实验数据如下表:
回答下列问题:
(1)上表中a=0.6000g,b=0.6000g,c=0.2000g.
(2)实验①的目的是作为实验②、③的对照,看MnO2、CuO对KClO3的分解能否起催化作用.
(3)本实验中为了比较CuO和MnO2对氯酸钾分解的催化能力,还需测量的数据是:相同时间内放出O2的量或放出等量的O2所需的时间.
(4)实验中为了更准确地说明CuO和MnO2对氯酸钾分解的催化能力,还应保持反应的温度相同,你将如何操作以保证反应温度相同用火焰大小相似的酒精灯加热相同时间或用控温电炉加热相同时间或水浴加热相同时间等.
(5)从反应残留物中回收催化剂,并称量其质量,目的是观察反应前后CuO、MnO2的质量是否发生变化,以进一步说明它们在反应中是否起催化作用.
| 实验编号 | m(KClO3)/g | m(MnO2)/g | m(CuO)/g | 回收催化剂质量/g |
| ① | 0.6000 | -- | -- | -- |
| ② | a | 0.2000 | -- | 0.1950 |
| ③ | b | -- | c | 0.1900 |
(1)上表中a=0.6000g,b=0.6000g,c=0.2000g.
(2)实验①的目的是作为实验②、③的对照,看MnO2、CuO对KClO3的分解能否起催化作用.
(3)本实验中为了比较CuO和MnO2对氯酸钾分解的催化能力,还需测量的数据是:相同时间内放出O2的量或放出等量的O2所需的时间.
(4)实验中为了更准确地说明CuO和MnO2对氯酸钾分解的催化能力,还应保持反应的温度相同,你将如何操作以保证反应温度相同用火焰大小相似的酒精灯加热相同时间或用控温电炉加热相同时间或水浴加热相同时间等.
(5)从反应残留物中回收催化剂,并称量其质量,目的是观察反应前后CuO、MnO2的质量是否发生变化,以进一步说明它们在反应中是否起催化作用.