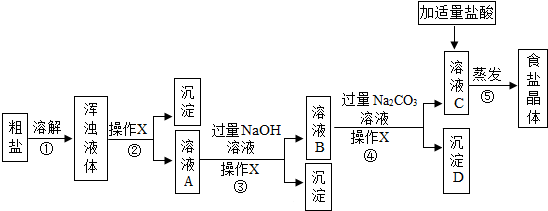
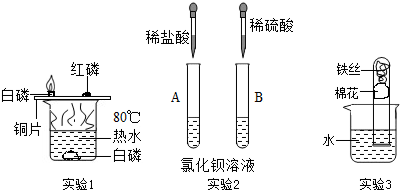
题目内容
4.将一定质量的NaCl和Na2CO3固体混合物加入到200g水中完全溶解,向其中加入一定质量分数的BaCl2溶液208g,恰好完全反应,过滤,得到19.7g沉淀,经测定滤液中含氯元素的质量为21.3g(假定过滤过程中物质无损失).计算:(Ⅰ)所加BaCl2溶液的溶质质量分数;
(Ⅱ)过滤后所得滤液的溶质质量分数.
分析 向氯化钠和碳酸钠的混合溶液中加入氯化钡溶液,氯化钡和碳酸钠发生反应生成碳酸钡沉淀和氯化钠,
Ⅰ根据碳酸钡沉淀的质量求出氯化钡的质量,再根据溶质质量分数的计算方法计算出氯化钡溶液中溶质的质量分数即可;
Ⅱ滤液中的氯化钠包括原混合物中的氯化钠和反应生成的氯化钠,根据氯元素的质量求出滤液中氯化钠的总质量,再用氯化钠的总质量-反应生成的氯化钠的质量(可根据碳酸钡的质量求出)即可求出原混合物中氯化钠的质量;根据碳酸钡的质量由反应的化学方程式求出碳酸钠的质量,进而根据溶质质量分数的计算公式进行计算即可.
解答 解:设所加的BaCl2溶液中BaCl2的质量为x,生成氯化钠的质量为y,参加反应的碳酸钠的质量为z.
Na2CO3+BaCl2=BaCO4↓+2NaCl
106 208 197 117
z x 19.7g y
$\frac{208}{x}$=$\frac{197}{19.7g}$
x=20.8g
所加BaCl2溶液的溶质质量分数:$\frac{20.8g}{208g}$×100%=10%;
$\frac{106}{z}$=$\frac{117}{y}$=$\frac{197}{19.7g}$
y=11.7g
z=10.6g
过滤后所得滤液为氯化钠溶液,根据题意,经测定滤液中含氯元素的质量为21.3g,则氯化钠的质量为21.3g÷$\frac{35.5}{58.5}$=35.1g
则原NaCl和Na2CO3固体混合物中氯化钠的质量为:35.1g-11.7g=23.4g,
过滤后所得滤液的溶质质量分数为:$\frac{35.1g}{14.2g+23.4g+200g+208g-19.7g}$×100%=8.2%.
故答案为:(1)所加BaCl2溶液的溶质质量分数为10%;
(2)过滤后所得滤液的溶质质量分数为8.2%.
点评 本道综合性较强,解答本题有三个突破点:一是根据复分解反应的条件判断是哪些物质发生反应;二是涉及到有关化学式的计算;三是准确找到滤液中的溶质及原混合物的质量.

| A. | 元素符号:铝--AL | B. | 化合价:$\stackrel{+2}{Cu}O$ | ||
| C. | 化学式:氧化铁--FeO | D. | 俗名:氢氧化钙--生石灰 |
| A. | 低血糖发作时,喝葡萄糖水比吃馒头见效快 | |
| B. | 骨质疏松的中老年人饮食中应增加含铁量丰富的食物 | |
| C. | 处于生长发育期的青少年对蛋白质的需求比成年人少 | |
| D. | 糖类、油脂和维生素都可以为人体提供能量 |
 甲、乙两种物质的溶解度曲线如图所示,下列说法中正确的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法中正确的是( )| A. | t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 | |
| B. | t2℃时,甲饱和溶液溶质质量分数为50% | |
| C. | t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和 | |
| D. | t1℃时,质量相同的甲、乙饱和溶液分别升温至t2℃,为达饱和状态,需加入甲的质量大于乙 |