题目内容
4.将一定质量分数的过量的氢氧化钠溶液和50g硫酸铜溶液混合,充分反应后,溶液呈碱性,并得到蓝色沉淀4.9g,求硫酸铜溶液的溶质质量分数.分析 氢氧化钠溶液与硫酸铜溶液反应生成氢氧化铜沉淀和硫酸钠,由生成沉淀的质量,由反应的化学方程式列式计算出参加反应的硫酸铜的质量,进而计算出硫酸铜溶液的溶质质量分数.
解答 解:设参加反应的硫酸铜的质量为x
2NaOH+CuSO4═Na2SO4+Cu(OH)2↓
160 98
x 4.9g
$\frac{160}{98}=\frac{x}{4.9g}$ x=8g
硫酸铜溶液的溶质质量分数为$\frac{8g}{50g}×$100%=16%.
答:硫酸铜溶液的溶质质量分数为16%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.某赤铁矿(主要成分是Fe2O3,其它成分不含铁)中铁元素含量为56%,该赤铁矿中Fe2O3的质量分数(纯度)是( )
| A. | 70% | B. | 80% | C. | 85% | D. | 90% |
1.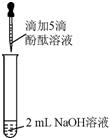 众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
进行实验】
【解释与结论】
(1)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(2)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与氢氧化钠溶液的浓度有关,氢氧化钠溶液浓度过高会使酚酞退色.
 众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.
众所周知,酚酞溶液遇NaOH溶液变红.但是,在分组实验中(如图所示),出现了意想不到的现象:溶液变红后褪色.【提出问题】分组实验中,出现意想不到的现象的原因是什么呢?
【猜想与假设】
Ⅰ.红色褪去,与NaOH溶液和空气中的CO2反应有关.
Ⅱ.红色褪去,与NaOH溶液的浓度有关.
进行实验】
| 实验 | 实验操作 | 实验现象 |
| 1 | 向盛有2mLNa2CO3溶液的试管中滴加5滴0.5%的酚酞溶液 | 溶液变红 |
| 2 | 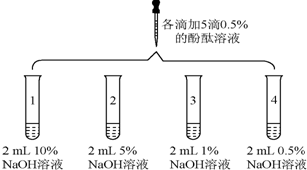 | 1号试管0.1min红色褪去 2号试管5min红色褪去 3号试管30min红色明显变浅 4号试管120min红色无明显变化 |
(1)实验1的现象表明,猜想与假设1不成立(填“成立”或“不成立”).
(2)由实验2得出结论:出现“溶液变红后褪色”现象的原因是与氢氧化钠溶液的浓度有关,氢氧化钠溶液浓度过高会使酚酞退色.
5.下列各组固体,只利用水不能进行鉴别的是( )
| A. | 碳酸钠和碳酸钙 | B. | 硝酸钾和氯化钾 | C. | 硫酸铜和氯化铁 | D. | 硫酸钠和硫酸钡 |
 在如图所示的装置中,集气瓶内充满二氧化碳气体,瓶口的双孔塞一孔插一根连接气球的玻璃管,另一孔插一支盛有氢氧化钠溶液的胶头滴管.把胶头滴管中的氢氧化钠溶液滴入瓶中,振荡.现象:气球膨胀,产生该现象的原因:二氧化碳与氢氧化钠溶液反应使瓶内压强减小.
在如图所示的装置中,集气瓶内充满二氧化碳气体,瓶口的双孔塞一孔插一根连接气球的玻璃管,另一孔插一支盛有氢氧化钠溶液的胶头滴管.把胶头滴管中的氢氧化钠溶液滴入瓶中,振荡.现象:气球膨胀,产生该现象的原因:二氧化碳与氢氧化钠溶液反应使瓶内压强减小.