题目内容
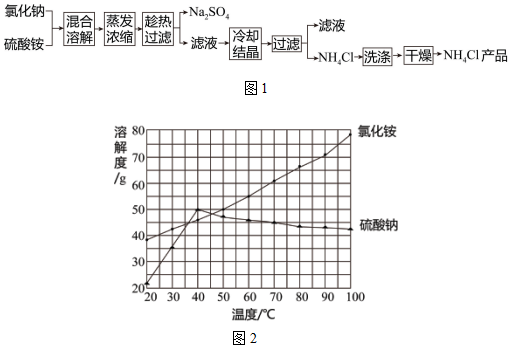
5.以氯化钠和硫酸铵为原料制各氯化铵及副产品硫酸钠,工艺流程如图1:己知:氮化铵受热能分解生成氯化氢气体和氨气,硫酸钠受热不易分解.
氯化铵和硫酸钠的溶解度随温度变化如图2所示.回答下列问题:
(1)实验室进行蒸发浓缩用到的主要仪器有蒸发皿、烧杯、玻璃棒、酒精灯等,蒸发时玻璃棒的作用是搅拌,使溶液受热均匀,防止液滴飞溅.
(2)“冷却结晶”过程中,析出NH4Cl晶体的合适温度范围为35~45℃.
(3)对得到的NH4Cl产品,不用其它试剂,检查其是否纯净的操作是加热一部分产品,若加热的产品全都消失,则产品纯净.
(4)用简单的化学方法验证副产品Na2SO4中含有NH4Cl加热副产品,若产生有刺激性气味气体,则副产品中含有NH4Cl.
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
(1)实验室进行蒸发浓缩用到的主要仪器有蒸发皿、烧杯、玻璃棒、酒精灯等,蒸发时玻璃棒的作用是搅拌,使溶液受热均匀,防止液滴飞溅.
(2)“冷却结晶”过程中,由于35~45℃硫酸钠的溶解度最大,所以在析出NH4Cl晶体的合适温度范围为 35~45℃.
(3)对得到的NH4Cl产品,不用其它试剂,而由于氯化铵受热分解生成两种气体,而硫酸钠受热不分解,所以检查其是否纯净的操作是加热一部分产品,若加热的产品全都消失,则产品纯净.
(4)用简单的化学方法验证副产品Na2SO4中含有NH4Cl,由于氯化铵受热分解生成两种刺激性气味的气体,而硫酸钠受热不分解,所以加热副产品,若产生有刺激性气味气体,则副产品中含有NH4Cl.
故答案为:
(1)蒸发皿;搅拌,使溶液受热均匀,防止液滴飞溅.
(2)35~45.
(3)加热一部分产品,若加热的产品全都消失,则产品纯净.
(4)加热副产品,若产生有刺激性气味气体,则副产品中含有NH4Cl.
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.

练习册系列答案
相关题目
16. 某校化学研究性学习小组,对施用化肥的利与弊进行了小组辩论,甲方的观点是使用化肥有利,下列甲方观点不正确的是 ( )
某校化学研究性学习小组,对施用化肥的利与弊进行了小组辩论,甲方的观点是使用化肥有利,下列甲方观点不正确的是 ( )
 某校化学研究性学习小组,对施用化肥的利与弊进行了小组辩论,甲方的观点是使用化肥有利,下列甲方观点不正确的是 ( )
某校化学研究性学习小组,对施用化肥的利与弊进行了小组辩论,甲方的观点是使用化肥有利,下列甲方观点不正确的是 ( )| A. | 施用化肥可使农作物增加产量 | |
| B. | 大量施用化肥不会造成环境污染 | |
| C. | 磷肥能促进农作物根系发达,增强养分的吸收 | |
| D. | 钾肥能促使农作物生长旺盛,茎秆粗壮 |
10.分类是学习和研究化学的常用方法.下列物质分类不正确的是( )
| A. | 有机物:乙醇 | B. | 碱:纯碱 | C. | 混合物:自来水 | D. | 盐:氯化铵 |
17.下列关于四种粒子的结构示意图的说法中,正确的是( )


| A. | ①③属于不同种元素 | B. | ④属于阴离子 | ||
| C. | ②③的化学性质相似 | D. | ②在化学反应中易失去电子 |
14.下列有关“侯氏制碱法”的叙述中,不正确的是( )
氨碱法生产纯碱的主要反应原理如下:NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl ②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
氨碱法生产纯碱的主要反应原理如下:NaCl+NH3+CO2+H2O═NaHCO3+NH4Cl ②2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
| A. | 加热时的稳定性:碳酸钠>碳酸氢钠 | |
| B. | 用食盐制纯碱还需要要含碳、氧元素的物质 | |
| C. | 配制饱和食盐水时,可通过搅拌来提高食盐的溶解度 | |
| D. | 向饱和食盐中先通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收 |
