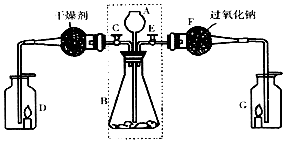
题目内容
5. 钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.
钛(Ti)因为具有许多神奇的性能而越来越引起人们的关注.(1)钛合金具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、钛合金与人体有很好的“相容性”等.根据它们的主要性能,下列用途不切合实际的是A.
A.用来作保险丝 B.用于制造航天飞机 C.用来制造人造骨 D.用于制造船舶
(2)某化学兴趣小组对Mg、Ti、Ag的金属活动性顺序进行探究.
【提出假设】三种金属的活动性分别是:
假设A:Ti>Mg>Ag;
假设B:Mg>Ag>Ti;
假设C:Mg>Ti>Ag.
【查阅资料】在相同条件下,金属与酸反应,产生气泡的速率越快,则该金属活动性越强.
【实验设计】同温下,取大小相同的这三种金属薄片,分别投入等体积、等质量分数的足量稀盐酸中,观察现象.请填空:
①三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去表面的氧化物.
②根据如表中的实验现象填空:
| Ti | Mg | Ag | |
| 实验现象 | 产生气泡速度缓慢 | 产生气泡速度快 | 无任何现象 |
③在做镁条与稀盐酸反应过程中观察到产生气体体积与反应时间有如图所示的关系:则0~t时间内反应速率逐渐加快的主要原因是反应放热,使反应速率加快.
④在【实验设计】中,如果所用盐酸的溶质质量分数不同,是否一定能够得出正确结论?否(填“是”或“否”),理由是反应物浓度会影响反应速率.
分析 (1)能够用作保险丝的物质熔点较低;
(2)三种金属的活动性可能是Ti>Mg>Ag;也可能是Mg>Ag>Ti;也可能是Mg>Ti>Ag;
三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去表面的氧化物;
镁和稀盐酸反应生成氯化镁和氢气;
温度越高、反应物浓度越大,反应速率越快.
解答 解:(1)钛合金熔点高,不能用作保险丝.
故填:A.
(2)【提出假设】三种金属的活动性可能是Ti>Mg>Ag;也可能是Mg>Ag>Ti;也可能是Mg>Ti>Ag.
故填:Mg>Ti>Ag.
【实验设计】①三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去表面的氧化物.
故填:除去表面的氧化物.
②镁和稀盐酸反应产生气泡速度快,钛和稀盐酸反应产生气泡速度缓慢,说明镁比钛活泼,银和稀盐酸混合无任何现象,说明银最不活泼;
镁和稀盐酸反应的化学方程式为:Mg+2HCl═MgCl2+H2↑.
故填:C;Mg+2HCl═MgCl2+H2↑.
③则0~t时间内反应速率逐渐加快的主要原因是反应放热,使反应速率加快.
故填:反应放热,使反应速率加快.
④在【实验设计】中,如果所用盐酸的溶质质量分数不同,不一定能够得出正确结论,理由是反应物浓度会影响反应速率.
故填:否;反应物浓度会影响反应速率.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
相关题目
15.近段时间,我国某些地区猪肉价格上涨幅度较大,因而有些不法分子常售出不新鲜的猪肉来坑害消费者.猪肉的新鲜度可以通地测试PH来判断.有资料显示,PH与猪肉的新鲜度的关系为:
猪肉在变质过程中酸性强弱的变化为( )
| 名称 | 新鲜肉 | 次鲜肉 | 变质肉 |
| pH | 5.8~6.2 | 6.3~6.6 | >6.7 |
| A. | 逐渐变弱 | B. | 保持不变 | C. | 逐渐变强 | D. | 无法确定 |
13.双氧水制取氧气时,忘记加入二氧化锰,其结果是( )
| A. | 不放出氧气 | B. | 放出氧气的速度慢 | ||
| C. | 放出氧气总量会减少 | D. | 放出氧气总量会减少且速度慢 |
20.下表是某研究性学习小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据.请你分析:该研究小组在设计方案时,考虑了浓度温度、催化剂、等因素对过氧化氢分解速率的影响.
用10mlH2O2溶液制取150mlO2所需的时间(秒):
用10mlH2O2溶液制取150mlO2所需的时间(秒):
| 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 |
| MnO2催化、不加热 | 10 | 25 | 60 |
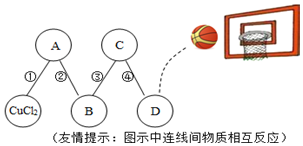
10.某课外兴趣小组的同学为了探究金属X、Y、Z三种金属的活动性顺序,进行实验进行了如下探究,请你加入他们一起完成探究:
实验一:把金属X、Y、Z三种金属分别放入硫酸溶液中
(1)Z与硫酸反应后,生成+3价金属离子,写出实验③的化学方程式2Z+3H2SO4═Z2(SO4)3+3H2↑(金属就用Z表示);
实验二:为了比较X、Y两种金属的活动性,把X、Y两种金属丝放入硝酸银溶液中.
(2)通过实验二并结合实验一的现象分析,可得出X、Y、Z金属活动性由强到弱的顺序为:Z>X>Y.
实验三:同学们接着对“Z丝和硫酸反应的快慢与什么因素有关”的课题开展探究,下表是他们分别用相同质量的Z丝和足量稀硫酸反应的三组实验数据:
(3)实验⑦和⑧表明:该反应快慢与温度有关;
(4)能表明硫酸浓度对反应快慢有影响的实验编号是⑥⑦;
(5)如果实验⑥中硫酸的质量分数换为4%,请预测Z丝消失的时间(用t表示)的取值范围300s<t<500s.
(6)该实验除了用Z丝消失的时间来衡量反应的快慢的方法外,你还能提出的一种新的方法是比较收集相同体积气体需要的时间.
实验一:把金属X、Y、Z三种金属分别放入硫酸溶液中
| 实验序号 | ① | ② | ③ |
| 实验步骤 | 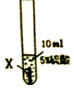 | 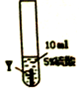 | 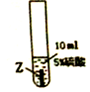 |
| 实验现象 | 在X片表面无明显变化 | Y片表面无明显变化 | Z片溶解,表面有无色氢气产生,溶液最终无色 |
实验二:为了比较X、Y两种金属的活动性,把X、Y两种金属丝放入硝酸银溶液中.
| 实验序号 | ④ | ⑤ |
| 实验步骤 | 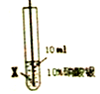 | 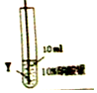 |
| 实验现象 | 在X丝表面有银白色的固体析出 | 在Y丝表面没有明显现象 |
实验三:同学们接着对“Z丝和硫酸反应的快慢与什么因素有关”的课题开展探究,下表是他们分别用相同质量的Z丝和足量稀硫酸反应的三组实验数据:
| 实验编号 | 硫酸的质量分数/% | 反应的温度 | Z丝消失的时间/S |
| ⑥ | 3 | 20 | 500 |
| ⑦ | 6 | 20 | 300 |
| ⑧ | 6 | 30 | 80 |
(4)能表明硫酸浓度对反应快慢有影响的实验编号是⑥⑦;
(5)如果实验⑥中硫酸的质量分数换为4%,请预测Z丝消失的时间(用t表示)的取值范围300s<t<500s.
(6)该实验除了用Z丝消失的时间来衡量反应的快慢的方法外,你还能提出的一种新的方法是比较收集相同体积气体需要的时间.
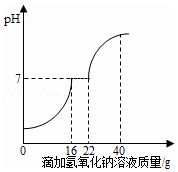 同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量
同学们发现实验室的工业盐酸呈黄色,老师解释说是因为里面含有氯化铁.为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量