题目内容
7.某同学向一定质量的石灰石中加入7.3%的稀盐酸来制取二氧化碳,测得反应过程中溶液的pH与加入的稀盐酸的关系如图1所示.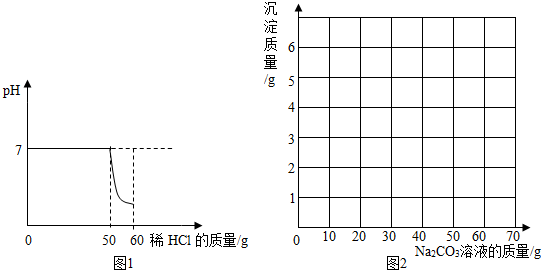
(1)该同学能收集到的二氧化碳的质量多少?(写出计算过程)
(2)该同学把制取气体后的废液过滤,向滤液中加入10.6%的Na2CO3溶液,测得加入的Na2CO3溶液与产生的沉淀数据如下:
| Na2CO3溶液质量/g | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 沉淀质量/g | 0 | 1 | n | 3 | 4 | 5 | m |
请在图2中画出向废液中加入Na2CO3溶液时加入的Na2CO3溶液与产生的沉淀的曲线.
分析 (1)根据图示可知与碳酸钙反应的HCl的质量=50g×7.3%=3.65g,结合方程式可以计算二氧化碳的质量.
(2)根据图表可知前10gNa2CO3溶液加入后没有生成沉淀,是Na2CO3与过量的盐酸反应,之后每消耗10gNa2CO3溶液产生1g沉淀,所以n=2,在根据氯化钙的质量分析生成沉淀的最大量,分析m的数值.
解答 解:(1)设生成的二氧化碳的质量为x,生成氯化钙的质量为y
与碳酸钙反应的HCl的质量=50g×7.3%=3.65g
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 111 44
3.65g y x
$\frac{73}{44}$=$\frac{3.65g}{x}$
x=2.2g
$\frac{73}{111}=\frac{3.65g}{y}$
y=5.55g
(2)设加入足量Na2CO3溶液后生成碳酸钙的质量为z,
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
5.55g z
$\frac{111}{5.55g}=\frac{100}{z}$
z=5g
当加入60gNa2CO3溶液时,已经生成沉淀5g,说明已经恰好反应,当加入70gNa2CO3溶液时,不再发生反应,生成沉淀也应该是5g,所以m=5.
根据图表可知前10gNa2CO3溶液,是Na2CO3与过量的盐酸反应,化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
所以向废液中加入Na2CO3溶液时加入的Na2CO3溶液与产生的沉淀的曲线为:
故答案为:(1)2.2g;(2)5;Na2CO3+2HCl═2NaCl+H2O+CO2↑.
点评 本题主要考查学生运用化学方程式进行计算的能力.学生须认真分析题意,找出各物质间的关系,正确写出方程式,才能正确解答.

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
| A. | 汞原子核内中子数为80 | |
| B. | 汞的核电荷数为80 | |
| C. | 汞的相对原子质量为200.6g | |
| D. | 汞原子的化学性质主要由原子核决定的 |
| 清洁产品 | 除垢净 | 去污粉 | 管道通 |
| 主要成分 | 盐酸 | 碳酸钠 | 氢氧化钠、铝粉 |
(2)去污粉与除垢净不能混合使用,其原因是Na2CO3+2HCl═2NaCl+CO2↑+H2O(用化学方程式表示).
(3)管道通使用时不能接触皮肤,原因是NaOH具有强烈的腐蚀性.使用时利用Al与NaOH溶液反应放出大量的热,以加快NaOH与淤积物的作用,该反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,其中铝元素的化合价变化为0~+3.
| 选项 | 物质(括号内为杂质) | 杂质 | 除杂的试剂和方法 |
| A | NaOH溶液(Na2SO4) | 过量的Ba(OH)2溶液 | 过滤 |
| B | KCl(MnO2) | 水 | 溶解、过滤、洗涤干燥 |
| C | CO(CO2) | 足量氢氧化钠溶液 | 通入并干燥 |
| D | NaCl溶液(Na2CO3) | 足量稀盐酸 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 酒精灯 | B. | 量筒 | C. | 烧杯 | D. | 玻璃棒 |

 ”表示1个氧原子,“
”表示1个氧原子,“ ”表示1个氢原子.
”表示1个氢原子. 中粒子数目及符号可表示为2H2.
中粒子数目及符号可表示为2H2.

