题目内容
7.含杂质的铁片10g(杂质不与稀硫酸反应)与100g的稀硫酸恰好完全反应,产生0.2g的氢气.(反应的化学方程式:Fe+H2SO4═FeSO4+H2↑)求:①铁片的纯度?
②该硫酸溶液的溶质质量分数?
③反应后所得溶液的溶质质量分数?
分析 根据氢气的质量结合化学方程式求出铁片中纯铁的质量,稀硫酸中溶质的质量和生成硫酸亚铁的质量,再求铁片的纯度,该硫酸溶液的溶质质量分数.
对于反应后所得溶液的质量可以根据质量守恒定律算出来,再求反应后所得溶液的溶质质量分数.
解答 解:设铁片中纯铁的质量为x,稀硫酸中溶质的质量为y,生成硫酸亚铁的质量为z.
Fe+H2SO4=FeSO4+H2↑
56 98 152 2
x y z 0.2g
$\frac{56}{x}=\frac{2}{0.2g}$,x=5.6g
$\frac{98}{y}=\frac{2}{0.2g}$,y=9.8g
$\frac{152}{z}=\frac{2}{0.2g}$,z=15.2g
铁片的纯度=$\frac{5.6g}{10g}×100%$=56%
稀硫酸中溶质的质量分数=$\frac{9.8g}{100g}$×100%=9.8%
反应后所得溶液的质量=$\frac{15.2g}{5.6g+100g-0.2g}×100%$=14.4%
答:铁片中纯铁的质量为5.6g;
稀硫酸中溶质的质量分数是9.8%;
反应后所得溶液的质量是14.4%.
点评 本题主要考查化学方程式的计算、溶质质量分数的计算.解答该题的关键是根据是知道反应后溶质是硫酸亚铁,溶液根据质量守恒定律求出.

练习册系列答案
相关题目
19.下列物质中,铁显+2价的是( )
| A. | Fe | B. | Fe2O3 | C. | FeCl3 | D. | FeSO4 |
16.工业上很多化学反应选择在溶液中进行的原因是( )
| A. | 易于操作 | B. | 设备简单 | C. | 不需加热 | D. | 反应快 |
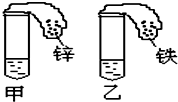 如图所示,在试管和小气球中分别先加入浓度、质量均相等的足量稀硫酸和等质量的金属锌、铁,然后将气球中的金属倒入试管中,观察到的现象是:试管中有气泡产生,开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束后,甲气球体积比乙气球小(填:大、小、一样大)
如图所示,在试管和小气球中分别先加入浓度、质量均相等的足量稀硫酸和等质量的金属锌、铁,然后将气球中的金属倒入试管中,观察到的现象是:试管中有气泡产生,开始时,甲气球迅速鼓起,而乙气球鼓起较慢;反应结束后,甲气球体积比乙气球小(填:大、小、一样大)
 A、B、C三种物质的溶解度曲线如下图所示,据此图回答:
A、B、C三种物质的溶解度曲线如下图所示,据此图回答: