题目内容
16.工业上很多化学反应选择在溶液中进行的原因是( )| A. | 易于操作 | B. | 设备简单 | C. | 不需加热 | D. | 反应快 |
分析 根据影响两种物质反应的速率的因素分析,两种物质的接触面积越大,反应速率越快;在溶液中进行的反应,物质的接触面积大.
解答 解:两种物质相互接触的面积越大,反应的速率越快,由于溶液是均一稳定的混合物,在溶液中两种物质接触面积大,化学反应的速率快.
故选:D.
点评 在溶液中两种物质接触面积大,反应速率快,所以许多化学反应都要在溶液中进行.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
6.下列有关水和溶液的说法中正确的是( )
| A. | 凡是均一、稳定的液体都是溶液 | |
| B. | 电解水时产生的氢气和氧气的质量比为2:1 | |
| C. | 相同温度下,饱和溶液一定比不饱和溶液浓 | |
| D. | 可用肥皂水可以区分软水和硬水 |
5.化学与生活息息相关,生活中处处涉及化学
(1)下列生活“小贴士”中的化学运用正确的是②④.
①春天播种;及时施碳铵(NH4HCO3)与草木灰(K2CO3)混合肥以增肥效
②夏天炎热;鱼池及时充氧以防缺氧
③秋天水果成熟;及时增施农药以保收成
④寒冬积雪;公路及时撒盐以保安全
(2)透视时通常服用一种乳白色的液体“钡餐”,其主要成分是BaSO4,该液体属于悬浊液(填“溶液”、“乳浊液”、“悬浊液”); 已知含Ba2+的溶液会使人中毒,若误服BaCO3会中毒,这是由于BaCO3+2HCl=BaCl2+H2O+CO2↑(填化学方程式),若误服,应立即服泻盐MgSO4,其理由是(填化学方程式)BaCl2+MgSO4=BaSO4↓+2MgCl.
(3)人体中的胃液主要成分是盐酸,过多会导致胃痛,特别是胃溃疡患者尤为严重,其应服用含【填NaOH、NaHCO3、Al(OH)3】的药物.其治疗原理是Al(OH)3+3HCl=AlCl3+3H2O(填化学方程式).
(4)用熟石灰中和一定量含盐酸的废水,溶液的pH与加入的熟石灰质量的关系如图1所示,熟石灰与盐酸反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O;若改用mg氢氧化钠与相同量的废水反应,所得溶液的pH<7(填“>”“<”或“=”).
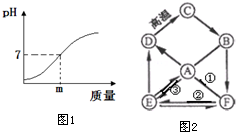
(5)A、B、C、D、E、F均为初中化学常见的物质,已知D在生活中常用作补钙剂和建筑材料,F为NaOH,它们之间存在的转化关系如图2,其中“→”表示由某种物质可转化为另一种物质,“-”表示两物质之间可以相互反应(部分反应物、生成物及反应条件已略去)其中.请按要求回答下列问题.
①用化学式表示:ENa2CO3;
②写出C→B的化学方程式是CaO+H2O=Ca(OH)2;
③题中没有涉及的化学基本反应类型是置换反应.
(6)实验室有甲、乙、丙三瓶溶液,分别含有以下六种物质中的两种:KOH、HNO3、AgNO3、KCl、K2SO4、Ba(NO3)2.经初步分析,情况如下:
为了进一步确定各溶液的组成,进行如下实验:(①已知溶液中不可能同时存在Ag+和OH-,②AgNO3显酸性,③两次混合均完全反应).根据以上信息回答:
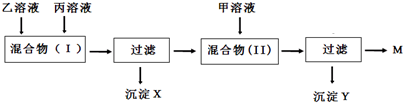
①甲溶液中肯定含有的物质是KOH(填化学式,下同),含有的另一种物质是K2SO4(或KCl),据此,沉淀X是AgCl(或BaSO4);
②根据(Ⅰ)的判断,混合(Ⅱ)中产生沉淀的化学方程式为:K2SO4+Ba(NO3)2═BaSO4↓+2KNO3;HNO3+KOH═H2O+KNO3或KCl+AgNO3═AgCl↓+KNO3;HNO3+KOH═H2O+KNO3;
③溶液M中溶质的化学式KNO3,它是一种复合肥,含有农作物所需的营养元素是K、N(填元素符号).
(1)下列生活“小贴士”中的化学运用正确的是②④.
①春天播种;及时施碳铵(NH4HCO3)与草木灰(K2CO3)混合肥以增肥效
②夏天炎热;鱼池及时充氧以防缺氧
③秋天水果成熟;及时增施农药以保收成
④寒冬积雪;公路及时撒盐以保安全
(2)透视时通常服用一种乳白色的液体“钡餐”,其主要成分是BaSO4,该液体属于悬浊液(填“溶液”、“乳浊液”、“悬浊液”); 已知含Ba2+的溶液会使人中毒,若误服BaCO3会中毒,这是由于BaCO3+2HCl=BaCl2+H2O+CO2↑(填化学方程式),若误服,应立即服泻盐MgSO4,其理由是(填化学方程式)BaCl2+MgSO4=BaSO4↓+2MgCl.
(3)人体中的胃液主要成分是盐酸,过多会导致胃痛,特别是胃溃疡患者尤为严重,其应服用含【填NaOH、NaHCO3、Al(OH)3】的药物.其治疗原理是Al(OH)3+3HCl=AlCl3+3H2O(填化学方程式).
(4)用熟石灰中和一定量含盐酸的废水,溶液的pH与加入的熟石灰质量的关系如图1所示,熟石灰与盐酸反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O;若改用mg氢氧化钠与相同量的废水反应,所得溶液的pH<7(填“>”“<”或“=”).

(5)A、B、C、D、E、F均为初中化学常见的物质,已知D在生活中常用作补钙剂和建筑材料,F为NaOH,它们之间存在的转化关系如图2,其中“→”表示由某种物质可转化为另一种物质,“-”表示两物质之间可以相互反应(部分反应物、生成物及反应条件已略去)其中.请按要求回答下列问题.
①用化学式表示:ENa2CO3;
②写出C→B的化学方程式是CaO+H2O=Ca(OH)2;
③题中没有涉及的化学基本反应类型是置换反应.
(6)实验室有甲、乙、丙三瓶溶液,分别含有以下六种物质中的两种:KOH、HNO3、AgNO3、KCl、K2SO4、Ba(NO3)2.经初步分析,情况如下:
| 溶液 | 外观 | pH | 溶液成分 | |
| 甲 | 无色、透明 | >7 | ? | ? |
| 乙 | 无色、透明 | =7 | Ba(NO3)2 | ? |
| 丙 | 无色、透明 | <7 | ? | ? |

①甲溶液中肯定含有的物质是KOH(填化学式,下同),含有的另一种物质是K2SO4(或KCl),据此,沉淀X是AgCl(或BaSO4);
②根据(Ⅰ)的判断,混合(Ⅱ)中产生沉淀的化学方程式为:K2SO4+Ba(NO3)2═BaSO4↓+2KNO3;HNO3+KOH═H2O+KNO3或KCl+AgNO3═AgCl↓+KNO3;HNO3+KOH═H2O+KNO3;
③溶液M中溶质的化学式KNO3,它是一种复合肥,含有农作物所需的营养元素是K、N(填元素符号).
15.以下叙述不正确的是( )
| A. | 钛和钛合金是制造飞机和轮船的理想材料 | |
| B. | 钙是人体中含量最多的金属元素 | |
| C. | 黄铜是铜、锌合金,它的硬度大于铜 | |
| D. | 焊锡的熔点比锡和铅都高 |