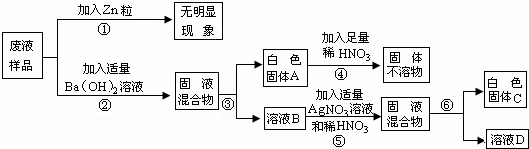
题目内容
18.木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如图1: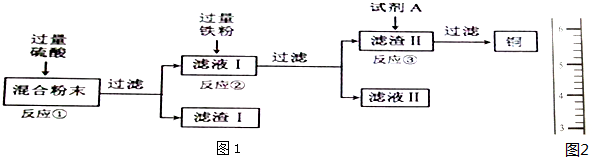
(1)写出下列反应的化学方程式:
反应①:CuO+H2SO4═CuSO4+H2O;
反应②:Fe+CuSO4═FeSO4+Cu.
(2)反应①所用的硫酸的质量分数为24.5%.现要配制40g24.5%的硫酸,需10g 98%的硫酸和30g水.实际操作时,用lOml量筒取98%的硫酸(密度为1.84g/cm3),请在答题卡图2中画出所取硫酸的液面.
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入烧杯中(填仪器名称),然后搅拌 (填操作名称),使反应充分进行.
(4)试剂A可选用H2SO4溶液(填一种物质的化学式).
(5)为了从混合粉末中回收更多的铜,可对实验方案进行修改和完善,你的建议是(提出一条即可)回收滤渣I中的铜.
分析 (1)氧化铜和稀硫酸反应生成硫酸铜和水,硫酸铜和铁反应生成硫酸亚铁和铜;
(2)溶液稀释前后,溶质质量不变;
(3)搅拌能使反应物接触更充分,从而使反应更彻底;
(4)稀硫酸能和铁反应生成硫酸亚铁和氢气;
(5)为了从混合粉末中回收更多的铜,应该把滤渣I中的铜进行回收.
解答 解:(1)反应①:氧化铜和稀硫酸反应的化学方程式为:CuO+H2SO4═CuSO4+H2O;
反应②:铁和硫酸铜反应的化学方程式为:Fe+CuSO4═FeSO4+Cu.
故填:CuO+H2SO4═CuSO4+H2O;Fe+CuSO4═FeSO4+Cu.
(2)设需要浓硫酸的质量为x,
根据题意有:x×98%=40g×24.5%,
x=10g,
需要水的质量为:40g-10g=30g,
故填:10;30.
需要的浓硫酸的体积为:10g÷1.84g/cm3=5.4mL,
所取硫酸的液面应该在5.4mL处,如下图所示:
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入烧杯中,然后用玻璃棒不断搅拌,使反应充分进行.
故填:烧杯;搅拌.
(4)试剂A可选用稀硫酸或稀盐酸,硫酸的化学式是H2SO4.
故填:H2SO4.
(5)为了从混合粉末中回收更多的铜,可对滤渣I中的铜进行回收.
故填:回收滤渣I中的铜.
点评 画量筒中的液面时,凹液面的最低处应该和5.4mL处相平,要注意理解.

练习册系列答案
相关题目
6.下列有关水和溶液的说法中正确的是( )
| A. | 凡是均一、稳定的液体都是溶液 | |
| B. | 电解水时产生的氢气和氧气的质量比为2:1 | |
| C. | 相同温度下,饱和溶液一定比不饱和溶液浓 | |
| D. | 可用肥皂水可以区分软水和硬水 |
13.二甲醚(C2H6O)具有清洁无污染,易于制造的特性,将有望成为一种全新的替代能源,在国内实现普及.下列有关二甲醚的说法错误的是( )
| A. | 二甲醚的相对分子质量为46 | |
| B. | 二甲醚不属于氧化物 | |
| C. | 二甲醚分子是由2个碳原子、6个氢原子和1个氧原子构成 | |
| D. | 二甲醚与甲烷分别在氧气中燃烧后的产物相同 |
10.下列图象与所对应操作相符的是( )
| A. |  对氢氧化钠溶液加水稀释 | |
| B. |  将等质量的镁片和铁片分别加入足量的稀硫酸混合 | |
| C. |  向HCl与CaCl2混合溶液中加入Na2CO3溶液 | |
| D. |  向一定量的氢氧化钠溶液中滴加稀盐酸 |
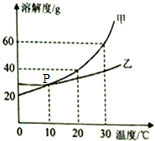 根据图中甲.乙两种物质的溶解度曲线,回答下列问题.
根据图中甲.乙两种物质的溶解度曲线,回答下列问题.