题目内容
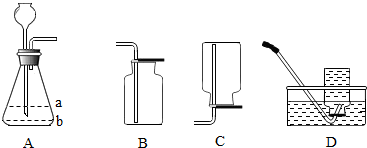
12.如图为实验室中常见的气体制备、净化、收集和性质实验的部分仪器,根据仪器装置和题目要求,回答下列问题:
(1)若以石灰石和稀盐酸为原料,在实验室中制备二氧化碳,并研究其有关性质,请回答:
①装置A中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑,基本反应类型为复分解反应.
②欲制备、收集一瓶干燥的CO2,所选仪器的连接顺序为ACE,检验CO2收集满的方法是用燃烧着的木条放在集气瓶口,如果熄灭,证明集气瓶内已充满二氧化碳..
③若向装置G中倒入适量澄清石灰水,迅速用预先绑有小气球的橡皮塞塞紧,振荡,观察到小气球变大,同时还观察到石灰水变浑浊,请你写出该过程中涉及的化学反应方程式CO2+Ca(OH)2=CaCO3↓+H2O.
(2)若用H2O2溶液为原料(MnO2作催化剂)反应制备干燥的氧气,并用来测定某10g铜粉样品的纯度(该样品中只含铜和碳),所选仪器的连接顺序为:A→C→B→D,实验结束后,若最终测得装置D增重ag(空气的影响忽略不计),则原样品中金属铜的质量是(10-$\frac{3}{11}$a)g.
分析 (1)①由实验室制取二氧化碳气体的药品为大理石和稀盐酸,二者接触就会发生反应,生成氯化钙和水和二氧化碳;是两种化合物相互交换成分,生成另外两种化合物的反应去分析;
②欲制备、收集一瓶干燥的CO2,所以要除去二氧化碳中的水分,二氧化碳可用向上排空气法收集去分析.
③从二氧化碳和石灰水反应生成不溶于水的碳酸钙和水,由于碳酸钙不溶于水,所以会出现白色浑浊现象;由于二氧化碳气体减少,瓶内气体压强减小,去分析.
(2)从铜与氧气反应生成氧化铜,碳与氧气反应生成二氧化碳,因此无法通过装置C的质量变化进行计算,但碳反应生成的二氧化碳被氢氧化钠吸收,因此可通过称量装置D反应前后的质量差求出二氧化碳的质量,从而求出碳的质量,进一步算出铜的质量.
解答 解:(1)①由实验室制取二氧化碳气体的药品为大理石和稀盐酸,二者接触就会发生反应,生成氯化钙和水和二氧化碳,其化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;是两种化合物相互交换成分,生成另外两种化合物的反应,所以属于复分解反应;
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑ 复分解反应;
②欲制备、收集一瓶干燥的CO2,所以要除去二氧化碳中的水分(浓硫酸具有吸水性可做干燥剂),由于二氧化碳的密度比空气大,所以可用向上排空气法收集,所以其顺序为:ACE;由于二氧化碳的密度比空气大,进入集气瓶后,沉积在集气瓶的底部,二氧化碳自下而上,充满集气瓶,当瓶口有二氧化碳时,说明二氧化碳已收集满,检验二氧化碳是否集满的方法是利用二氧化碳既不燃烧也不支持燃烧,用燃烧着的木条放在集气瓶口,如果熄灭,证明集气瓶内已充满二氧化碳.故答案为:ACE 用燃烧着的木条放在集气瓶口,如果熄灭,证明集气瓶内已充满二氧化碳.
③二氧化碳和石灰水反应生成不溶于水的碳酸钙和水,由于碳酸钙不溶于水,所以会出现白色浑浊现象;其化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;由于二氧化碳气体减少,瓶内气体压强减小,在外部大气压的作用下,所以气球变大;故答案为:变大 变浑浊 CO2+Ca(OH)2=CaCO3↓+H2O.
(2)铜与氧气反应生成氧化铜,碳与氧气反应生成二氧化碳,因此无法通过装置C的质量变化进行计算,但碳反应生成的二氧化碳被氢氧化钠吸收,因此可通过称量装置D反应前后的质量差求出二氧化碳的质量,从而求出碳的质量,进一步算出铜的质量.装置D增重ag,说明生成二氧化碳的质量为ag.
则二氧化碳中碳元素的质量为:ag×$\frac{12}{44}$=$\frac{3}{11}$ag;根据质量守恒定律可得混合物中碳元素就是二氧化碳中碳元素的质量;故混合物中铜的质量为:10g-$\frac{3}{11}$ag;故答案为:(10-$\frac{3}{11}$a);
点评 本题变相考查了二氧化碳的性质、实验室制法、质量守恒定律的应用等,综合性强,难度较大.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案| 选项 | 物质 | 鉴别方法 |
| A | 氧化铜粉末和铁粉 | 用磁铁吸引 |
| B | 氢氧化钠和硝酸铵 | 加水后测温度变化 |
| C | 氯化铵和硫酸铵 | 加入熟石灰粉末研磨 |
| D | 羊毛纤维和合成纤维 | 点燃后闻气味 |
| A. | A | B. | B | C. | C | D. | D |
| 质量/g | |
| 坩埚 | W |
| 坩埚+FeSO4•xH2O | W1 |
| 坩埚+FeSO4 | W2 |
 为验证混合气体中是否含有CO,CO2,H2O,H2 这四种气体,现有无水硫酸铜,澄清石灰水,浓硫酸,氢氧化钠溶液以及如图所示装置甲.能验证这四种气体的方法正确的是( )
为验证混合气体中是否含有CO,CO2,H2O,H2 这四种气体,现有无水硫酸铜,澄清石灰水,浓硫酸,氢氧化钠溶液以及如图所示装置甲.能验证这四种气体的方法正确的是( )| A. | 依次通入无水硫酸铜,澄清石灰水,浓硫酸,甲装置,无水硫酸铜,澄清石灰水 | |
| B. | 依次通入无水硫酸铜,澄清石灰水,甲装置,无水硫酸铜,澄清石灰水 | |
| C. | 依次通入澄清石灰水,无水硫酸铜,浓硫酸,甲装置,无水硫酸铜,澄清石灰水 | |
| D. | 依次通入无水硫酸铜,澄清石灰水,浓硫酸,甲装置,澄清石灰水,无水硫酸铜 |

| A. | ①②属于同种元素 | B. | ②④具有相对稳定结构 | ||
| C. | ①③都容易失去电子 | D. | ②④形成的化合物为NaCl |
| A. | 用干冰做制冷剂 | B. | 用金刚石切割玻璃 | ||
| C. | 用天然气作燃料 | D. | 发烧病人用酒精擦身体降温 |