题目内容
12. 将10.0g铜锌合金的粉末置于烧杯中,然后向其中加入100.0g的稀硫酸溶液,恰好完全反应,测得烧杯中溶液质量的变化关系如下图所示(不考虑物质耗损).
将10.0g铜锌合金的粉末置于烧杯中,然后向其中加入100.0g的稀硫酸溶液,恰好完全反应,测得烧杯中溶液质量的变化关系如下图所示(不考虑物质耗损).(1)得到纯净的铜粉还需要进行的操作是过滤、洗涤、干燥.
(2)求该铜锌合金中锌的质量分数.
(可能用到的相对原子质量:H-1 O-16 S-32 Cu-63.5 Zn-65)
分析 锌与稀硫酸反应生成硫酸锌溶液和氢气,铜不与稀硫酸反应;由烧杯中溶液质量的变化关系图,溶液质量增加的质量为106.3g-100.0g=6.3g,据此结合差量法,进行分析解答.
解答 解:(1)锌与稀硫酸反应生成硫酸锌溶液和氢气,铜不与稀硫酸反应,恰好完全反应后,得到纯净的铜粉还需要进行的操作是过滤、洗涤、干燥.
(2)设该铜锌合金中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑ 溶液质量增加的量
65 2 65-2=63
x 106.3g-100.0g=6.3g
$\frac{65}{63}=\frac{x}{6.3g}$ x=6.5g
该铜锌合金中锌的质量分数为$\frac{6.5g}{10.0g}×$100%=65%.
答:(1)过滤、洗涤、干燥;(2)该铜锌合金中锌的质量分数为65%.
点评 本题难度不大,考查利用化学方程式的计算,利用液体差量法是正确解答本题的关键和捷径.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
2.将一定量的乙醇和氧气置于一个完全封闭的容器中引燃,反应生成二氧化碳、水蒸气和一种未知物X.测得反应前后物质的质量如下表,下列判断不正确的是( )
| 物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
| 反应前质量g | 4.6 | 8 | 0 | 0 | 0 |
| 反应后质量g | 0 | 0 | 4.4 | 5.4 | m |
| A. | 表中m的值为2.8 | B. | 物质X中一定含有碳元素 | ||
| C. | 增加氧气的量可以减少X的生成 | D. | 物质X的化学式是C |
17.下列各组溶液,不加其它试剂就能鉴别的是( )
| A. | Na2CO3 HCl H2SO4 NaNO3 | B. | K2CO3 H2SO4 HNO3 BaCl2 | ||
| C. | HCl AgNO3 HNO3 NaCl | D. | NaOH FeCl3 MgCl2 BaCl2 |
7.气体的实验室制取是初中科学非常重要的一组实验,结合下列实验装置图回答有关问题:
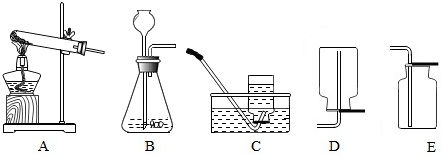
(1)在初中科学可同时用来制O2和CO2的发生装置是B(填字母).
(2)下表是某研究小组探究用过氧化氢制取氧气时,影响反应速率因素的相关实验数据.
通过实验Ⅰ和Ⅱ对比可知,化学反应速率与反应物浓度有关;从实验Ⅲ和Ⅳ对比可知,化学反应速率与温度的关系是温度越高,化学反应速率越快;
(3)将由氯酸钾和二氧化锰组成的混合物30克加热一段时间后,停止加热,冷却后称得剩余固体为25.2克,经分析,在剩余固体中,二氧化锰的质量分数为25%,求:
①生成的氧气的质量;②原混合物中二氧化锰的质量;③剩余固体中有多少质量的氯化钾?

(1)在初中科学可同时用来制O2和CO2的发生装置是B(填字母).
(2)下表是某研究小组探究用过氧化氢制取氧气时,影响反应速率因素的相关实验数据.
| 实验 序号 | 过氧化氢溶 液浓度/% | 过氧化氢溶 液体积/ml | 温度/ ℃ | 二氧化锰的 量/g | 收集氧气体 积/ml | 反应所需时 间/s |
| Ⅰ | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| Ⅱ | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| Ⅲ | 30 | 5 | 35 | 2 | 49.2l | |
| Ⅳ | 30 | 5 | 55 | 2 | 10.76 |
(3)将由氯酸钾和二氧化锰组成的混合物30克加热一段时间后,停止加热,冷却后称得剩余固体为25.2克,经分析,在剩余固体中,二氧化锰的质量分数为25%,求:
①生成的氧气的质量;②原混合物中二氧化锰的质量;③剩余固体中有多少质量的氯化钾?

