题目内容
20.用海水晒盐可以获得食盐,称为粗盐,粗盐通过精制可获得纯净的氯化钠.
(1)粗盐中常含有一些泥沙,在实验中要获得少量较纯净的氯化钠,可选用下图所示的操作完成,你的选择是①④⑤(按操作顺序填写序号),实验操作④中的玻璃棒的作用是引流.
(2)要配制100g2%的食盐水,需要加水的质量是98g.配制操作也可以在上图中选择,你的选择是②③①(按操作顺序填写序号).配制好的食盐水转移至试剂瓶时,不慎洒出,则剩余溶液的溶质质量分数不变(用“变大”、“变小”、“不变”填空).
(3)医疗使用的生理盐水的溶质质量分数约为0.9%,要配制500g生理盐水,需要225g2%的食盐水来稀释.
分析 (1)粗盐提纯是通过溶解把不溶物与食盐初步分离、过滤把不溶物彻底除去、蒸发把食盐从溶液中分离出来而得到食盐的过程;其操作顺序应为溶解-过滤-蒸发;
(2)依据溶质的质量=溶液的质量×溶质的质量分数,溶剂的质量=溶液的质量-溶质的质量计算;根据配制溶液的步骤及溶液的特征分析;
(3)根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.
解答 解:(1)粗盐提纯的主要步骤:
①溶解,将粗盐逐渐加入盛有水的烧杯里,边加边用玻璃棒搅拌(玻璃棒的作用是搅拌,加速溶解),直加到粗盐不再溶解时为止,观察所得食盐水是否浑浊;
②过滤,过滤食盐水,仔细观察滤纸上剩余物及滤液颜色,如滤液浑浊,应再过滤一次;
③蒸发,把所得滤液倒入蒸发皿,用酒精灯加热,待蒸发皿中出现较多固体时,停止加热,利用余热蒸干.
图中①是溶解,④是过滤,⑤是蒸发;过滤实验中玻璃棒的作用是引流;
故填:①④⑤;引流;
(2)称量氯化钠的质量是100g×2%=2g;需要水的质量是100g-2g=98g,配制的步骤为计算、称量、溶解,因此操作顺序为②③①;因为溶液具有均一性,因此
配制好的食盐水转移至试剂瓶时,不慎洒出,则剩余溶液的溶质质量分数不变;
故填:98;②③①;不变;
(3)设需要溶质质量分数约为2%的氯化钠溶液的质量为x,根据溶液稀释前后,溶质的质量不变,
则500g×0.9%=x×2% x=225g;
故填:225.
点评 本题难度不大,灵活运用溶质质量分数的有关计算、溶液稀释前后溶质的质量不变是正确解答本题的关键所在.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列实验现象描述不正确的是( )
| A. | 红磷燃烧产生大量的白烟 | |
| B. | 木炭在空气中燃烧,生成二氧化碳气体 | |
| C. | 硫在空气中燃烧,产生淡蓝色火焰 | |
| D. | 铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 |
15.人教版新课标化学教材九年级上册“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”的研究性实验,引起了化学探究小组的兴趣.
【实验探究】
【实验结论】
(1)A中产生的气体是氧气;
(2)实验Ⅱ、Ⅲ证明:氧化铁的质量和化学性质在反应前后均没有变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字表达式过氧化氢$\stackrel{三氧化二铁}{→}$水+氧气;
【实验评价】
(1)设计实验Ⅳ的目的是探究氧化铁的催化效果是否比二氧化锰的更好;
(2)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是:二氧化锰更适合做过氧化氢分解生成氧气的催化剂.
【实验拓展】
查阅资料得知:氧化铜、硫酸铜、猪肝、马铃薯等也可以作过氧化氢溶液分解的催化剂.
【实验探究】
| 实验步骤 | 实验现象 |
| Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象 | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象 |
| Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象 | 试管中均产生气泡,带火星木条均复燃 |
| Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag | |
| Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象 |
(1)A中产生的气体是氧气;
(2)实验Ⅱ、Ⅲ证明:氧化铁的质量和化学性质在反应前后均没有变化,可以作过氧化氢分解的催化剂;
(3)写出氧化铁催化过氧化氢分解的文字表达式过氧化氢$\stackrel{三氧化二铁}{→}$水+氧气;
【实验评价】
(1)设计实验Ⅳ的目的是探究氧化铁的催化效果是否比二氧化锰的更好;
(2)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是:二氧化锰更适合做过氧化氢分解生成氧气的催化剂.
【实验拓展】
查阅资料得知:氧化铜、硫酸铜、猪肝、马铃薯等也可以作过氧化氢溶液分解的催化剂.
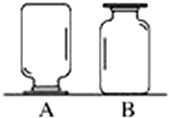 如图,在实验台上放置两瓶气体,集气瓶A、B中盛有二氧化碳(密度比空气的大)、氧气(密度比空气的大)、氢气(密度比空气的小)中的一种.小刚和小强想对瓶中气体进行探究:
如图,在实验台上放置两瓶气体,集气瓶A、B中盛有二氧化碳(密度比空气的大)、氧气(密度比空气的大)、氢气(密度比空气的小)中的一种.小刚和小强想对瓶中气体进行探究: 将10.0g铜锌合金的粉末置于烧杯中,然后向其中加入100.0g的稀硫酸溶液,恰好完全反应,测得烧杯中溶液质量的变化关系如下图所示(不考虑物质耗损).
将10.0g铜锌合金的粉末置于烧杯中,然后向其中加入100.0g的稀硫酸溶液,恰好完全反应,测得烧杯中溶液质量的变化关系如下图所示(不考虑物质耗损).