题目内容
5. 我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.(1)实验室制取气体时,确定发生装置需要考虑的两个因素有AC(填序号);
A.反应物的状态 B.气体的密度
C.反应的条件 D.气体的溶解性
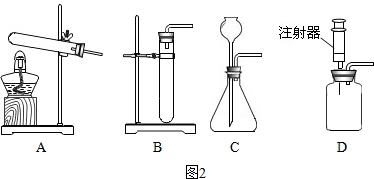
(2)某实验室的仪器柜里有如图1的仪器:写出图中标号①仪器的名称长颈漏斗.实验室用大理石和稀盐酸制备并收集一瓶干燥的二氧化碳时,不可能选择的仪器是②⑤(填序号);
(3)老师问:“如果实验室在没有大理石的情况下能否用碳酸钠粉末与稀盐酸来制取二氧化碳呢?”,大多数同学认为可以,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是D(填序号),该装置的最大优点是能控制反应速率.
(4)某实验小组还利用下图装置对实验室制取CO2的速率快慢进行了研究.他们实验时所用的试剂和使用的反应条件如下表所示:
| 盐酸 | 大理石 | 温度条件 |
| 5% | 细颗粒 | 20℃ |
| 10% | 粗颗粒 | 40℃ |
| 每次用量均20mL | 每次用量均5g |
| 实验编号 | 温度 | 大理石规格 | HCl浓度 | 探究目的 |
| ① | 20℃ | 粗颗粒 | 5% | (I)实验①和②探究浓度对反应快慢的影响; (II)实验②和④探究温度对反应快慢的影响; (III)实验①和③③探究大理石粗、细对反应快慢的影响. |
| ② | 20℃ | 粗颗粒 | 10% | |
| ③ | 20℃ | 细颗粒 | 5% | |
| ④ | 40℃ | 粗颗粒 | 10% |
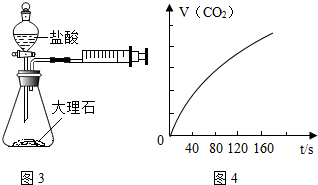 实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
分析 (1)根据实验室制取气体时,确定发生装置需要考虑的两种因素有反应物的状态和反应的条件进行解答;
(2)根据常见仪器的名称以及实验室用大理石和稀盐酸制备并收集二氧化碳时选择的发生装置和收集装置进行解答;
(3)根据碳酸钠粉末与稀盐酸反应生成氯化钠、水和二氧化碳以及该反应是固体和液体混合不需要加热的反应进行解答;
(4)根据对比实验的操作要点、实验需要注意的事项及影响反应速率的因素进行分析解答.
解答 解:(1)实验室制取气体时,确定发生装置需要考虑的两种因素有反应物的状态和反应的条件;而气体的密度和溶解性则是收集气体装置要考虑的因素;
(2)仪器①的名称是长颈漏斗;实验室用大理石和稀盐酸制备并收集二氧化碳时,属于固体和液体混合不需要加热的反应,所以不需要酒精灯,二氧化碳能溶于水,所以不能用排水法收集,所以也不用⑤;
(3)碳酸钠粉末与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑;该反应是固体和液体混合不需要加热的反应,所以最合适的一套装置是D,该装置的最大优点是能控制反应速率.
(4)①和②做比较,其它条件不变,只改变浓度,因此②的浓度是10%;②和④做比较,只改变温度,因此③的温度为20℃;①和③做比较,探究粗细对反应速度的影响,④中填粗颗粒;他们每次收集CO2气体均为40mL,因此还应记录的实验数据是:收集40mL的CO2所需要的时间.在80秒以后,产生CO2逐渐减慢的可能原因是:盐酸反应了一部分,盐酸浓度变低.
故答案为:(1)AC;(2)长颈漏斗;②⑤;(3)Na2CO3+2HCl=2NaCl+H2O+CO2↑; D;能控制反应速率;(4)②:10%;③:20℃;④:粗颗粒;(II):④;(III):③;收集40mL的CO2所需要的时间;80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
点评 化学是一门以实验为基础的学科,因此实验仪器的使用,装置的选择,实验原理,注意事项,气体的检验,都是中考热点.

| A. | 煤燃烧时向煤炉中鼓入空气 | B. | 面团发酵时放在温热处 | ||
| C. | 某些食品密封包装时充入氮气 | D. | 用双氧水制氧气加入二氧化锰 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 | 54.0 | 56.7 | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.1 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 | 71.3 | 77.3 | |
| KNO3 | 13.3 | 20.4 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 | 246 | |
(2)以上四种物质中温度变化对溶解度的彩响最小的物质是NaCl;
(3)以上四种物质在农业上可用作复合肥的是KNO3;
(4)从含有少量的NaCl的KNO3溶液中得到KNO晶体的结晶较纯的方法是降温结晶;
(5)分别把1OO℃的NaCl、KCl、NH4Cl、KNO3饱和溶液降温至10℃时所得溶液的溶质质量分数最小的是硝酸钾溶液.
| A. | 硫和氧 | B. | 氢和氧 | C. | 只有硫 | D. | 氢、硫、氧 |
| A. | 氧气、冰水混合物、空气 | B. | 氮气、过氧化氢溶液、钢 | ||
| C. | 冰、干冰、生石灰 | D. | 金刚石、熟石灰、石油 |
| A. |  稀释等质量溶质质量分数分别为30%和10%的H2SO4溶液 | |
| B. |  等质量的Al、Zn与足量的等溶质质量分数的稀硫酸反应 | |
| C. |  用等质量、等容质质量分数的过氧化氢溶液分别制取氧气 | |
| D. |  向氯化铜和硝酸铜的混合溶液中滴加氢氧化钠溶液 |
 如图所示的举重比赛中,涉及到许多物理、化学知识,如运动员在结束该次动作时,杠铃总会重重的落在地上,这是因为杠铃受到重力的作用,运动员举着杠铃在如图位置停留几秒钟,此时运动员不做功(填“做功”或“不做功”),运动员赛前所擦“镁粉”的化学名称叫“碳酸镁”,请写出其化学式为MgCO3.
如图所示的举重比赛中,涉及到许多物理、化学知识,如运动员在结束该次动作时,杠铃总会重重的落在地上,这是因为杠铃受到重力的作用,运动员举着杠铃在如图位置停留几秒钟,此时运动员不做功(填“做功”或“不做功”),运动员赛前所擦“镁粉”的化学名称叫“碳酸镁”,请写出其化学式为MgCO3.
 随着人们对身体健康、生活质量的关注程度不断提高,越来越多的人喜爱上了既可以锻炼身体,又可以欣赏自然美景,还可以愉悦身心的爬山活动,成为众多“驴友”中的一员.
随着人们对身体健康、生活质量的关注程度不断提高,越来越多的人喜爱上了既可以锻炼身体,又可以欣赏自然美景,还可以愉悦身心的爬山活动,成为众多“驴友”中的一员.