题目内容
16.下列做法是为了把化学反应变慢的是( )| A. | 煤燃烧时向煤炉中鼓入空气 | B. | 面团发酵时放在温热处 | ||
| C. | 某些食品密封包装时充入氮气 | D. | 用双氧水制氧气加入二氧化锰 |
分析 根据温度、浓度、催化剂、接触面积对反应速率有较大的影响;一般来说,增大浓度、增大压强、升高温度、加入催化剂或增大固体的表面积,可增大反应速率,反之反应速率减小.
解答 解:A、煤燃烧时向煤炉中鼓入空气,增大了氧气的浓度,燃烧更充分,反应速率加快,故选项错误.
B、面团发酵时放在温热处,温度较高,加快了化学反应速率,故选项错误.
C、某些食品密封包装时充入氮气,氮气的化学性质不活泼,能作保护气,可以防止食品与氧气的接触,减慢了反应速率,故选项正确.
D、用双氧水制氧气加入二氧化锰,二氧化锰作催化剂,加快了化学反应的速率,故选项错误.
故选:C.
点评 本题难度不大,本题考查影响反应速率的因素,了解温度、浓度、催化剂、接触面积对反应速率的影响是正确解答本题的关键.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
7.下列各组物质中括号内物质为杂质,写出除去杂质的方程式(或方法).
| 主要物质(杂质) | 化学方程式(或方法) |
| FeSO4(CuSO4) | |
| KCl(K2CO3) | |
| KCl(K2SO4) | |
| CO2(CO) | |
| CO(CO2) | |
| NaNO3(CuSO4) | |
| KNO3(NaCl) |
11.洛阳牡丹瓷名扬中外,开创了中国陶瓷新纪元.其烧制原料高岭土中的主要成分为Al2(Si205)(OH)4o下列说法不正确的( )
| A. | 高岭土属于混合物 | |
| B. | 高岭土的主要成分是由四种元素组成的 | |
| C. | 高岭土的主要成分中硅元素的化合价为+4 | |
| D. | 高岭土的主要成分中铝元素的质量分数最小 |
1.下列属于纯净物的是( )
| A. | 铁锈 | B. | 乙醇 | C. | 加碘盐 | D. | 蛋壳 |
8.下列有关燃烧和灭火的说法中,不正确的是( )
| A. | 风助火威--为燃烧提供足够多的氧气 | |
| B. | 杯水车薪一水少了不能降低温度使温度低于可燃物的着火点 | |
| C. | 釜底袖薪一隔离可燃物可以灭火 | |
| D. | 水火不容--用水可以灭火,是因为降低了可燃物的着火点 |
5. 我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
(1)实验室制取气体时,确定发生装置需要考虑的两个因素有AC(填序号);
A.反应物的状态 B.气体的密度
C.反应的条件 D.气体的溶解性
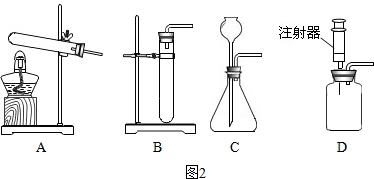
(2)某实验室的仪器柜里有如图1的仪器:写出图中标号①仪器的名称长颈漏斗.实验室用大理石和稀盐酸制备并收集一瓶干燥的二氧化碳时,不可能选择的仪器是②⑤(填序号);
(3)老师问:“如果实验室在没有大理石的情况下能否用碳酸钠粉末与稀盐酸来制取二氧化碳呢?”,大多数同学认为可以,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是D(填序号),该装置的最大优点是能控制反应速率.
(4)某实验小组还利用下图装置对实验室制取CO2的速率快慢进行了研究.他们实验时所用的试剂和使用的反应条件如下表所示:
实验小组同学设计的实验方案部分如下表,请根据表中信息帮助填写完整.
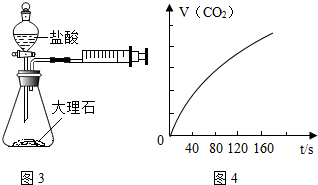 实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
 我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.
我们学习过常见气体的实验室制法,知道了制取气体的一般思路和方法.(1)实验室制取气体时,确定发生装置需要考虑的两个因素有AC(填序号);
A.反应物的状态 B.气体的密度
C.反应的条件 D.气体的溶解性
(2)某实验室的仪器柜里有如图1的仪器:写出图中标号①仪器的名称长颈漏斗.实验室用大理石和稀盐酸制备并收集一瓶干燥的二氧化碳时,不可能选择的仪器是②⑤(填序号);
(3)老师问:“如果实验室在没有大理石的情况下能否用碳酸钠粉末与稀盐酸来制取二氧化碳呢?”,大多数同学认为可以,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.为了完成该实验,有四位同学组装了以下发生装置,你认为最合适的一套装置是D(填序号),该装置的最大优点是能控制反应速率.

(4)某实验小组还利用下图装置对实验室制取CO2的速率快慢进行了研究.他们实验时所用的试剂和使用的反应条件如下表所示:
| 盐酸 | 大理石 | 温度条件 |
| 5% | 细颗粒 | 20℃ |
| 10% | 粗颗粒 | 40℃ |
| 每次用量均20mL | 每次用量均5g |
| 实验编号 | 温度 | 大理石规格 | HCl浓度 | 探究目的 |
| ① | 20℃ | 粗颗粒 | 5% | (I)实验①和②探究浓度对反应快慢的影响; (II)实验②和④探究温度对反应快慢的影响; (III)实验①和③③探究大理石粗、细对反应快慢的影响. |
| ② | 20℃ | 粗颗粒 | 10% | |
| ③ | 20℃ | 细颗粒 | 5% | |
| ④ | 40℃ | 粗颗粒 | 10% |
 实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢.
实验探究时,他们每次收集CO2气体均为40mL,则实验中他们还应记录的实验数据是收集40mL的CO2所需要的时间.图4是根据某次实验数据作出的CO2和时间变化的关系曲线,请分析在80秒以后,产生CO2逐渐减慢的可能原因:80秒后,盐酸反应了一部分,盐酸的浓度变低,反应速率变慢. 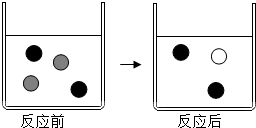 向AgNO3溶液中加入过量的铜粉充分反应,回答下列问题:
向AgNO3溶液中加入过量的铜粉充分反应,回答下列问题: Ag+、
Ag+、 Cu2+.
Cu2+.